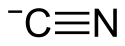Kyanid amonný
| Kyanid amonný | |
|---|---|
 Amonný ion | |
Kyanidový ion | |
| Obecné | |
| Systematický název | Kyanid amonný |
| Funkční vzorec | NH4CN |
| Sumární vzorec | CH4N2 |
| Vzhled | Bílá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 12211-52-8 |
| Vlastnosti | |
| Molární hmotnost | 44,056 g/mol |
| Teplota tání | 36 °C |
| Teplota varu | Rozklad (na NH3 a HCN) |
| Hustota | 1,02 g/cm3 |
| Rozpustnost ve vodě | rozpustný |
| Bezpečnost | |
| H-věty | H300 H310 H330 H410 |
| R-věty | R26/27/28 R32 R50/53 |
| S-věty | (S1/2) S7 S28 S29 S45 S60 S61 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Kyanid amonný je bílá anorganická látka se vzorcem NH4CN.
Výroba
Kyanid amonný lze vyrábět reakcí kyanovodíku s amoniakem. Je-li použito plynných reaktantů, vznikající produkt je vysoce čistý a velice jemně práškovitý. Reakce probíhá dle rovnice:
HCN + NH3 → NH4CN
. Další možností výroby je reakce chloroformu s hydroxidem (nejčastěji sodným) a amoniakem. Meziproduktem této reakce je kyanovodík. Výsledný produkt je však kontaminován chloridem sodným, který je obtížné odstranit.
CHCl3 + 2NH3 + 3NaOH + H2O → 3NaCl + 4H2O + NH3 + HCN → 3NaCl + 4H2O + NH4CN.
Tuto reakci je možné provádět v jedné nádobě, či zvlášť smíchat chloroform s hydroxidem sodným a vzniklý plynný kyanovodík smíchat s plynným amoniakem, proběhne reakce, která je již zmíněna výše. Další možností je reakce kyanidu vápenatého s uhličitanem amonným (popř. síranem amonným), podle rovnic:
Ca(CN)2 + (NH4)2CO3 → 2NH4CN + CaCO3
Ca(CN)2 + (NH4)2SO4 → 2NH4CN + CaSO4
Výhodou je, že vzniklé vedlejší produkty, uhličitan vápenatý a síran vápenatý, jsou nerozpustné ve vodě a které je možné snadno oddělit.
Reakce
Kyanid amonný reaguje se silnými kyselinami za vzniku kyanovodíku, například s kyselinou chlorovodíkovou reaguje podle rovnice:
NH4CN + HCl → NH4Cl + HCN
Se zásadami reaguje za vzniku amoniaku, dle reakce (s například hydroxidem sodným):
NH4CN + NaOH → NaCN + NH3 + H2O
S anorganickými solemi reaguje za vzniku příslušných kyanidů, například s chloridem hlinitým:
3NH4CN + AlCl3 → Al(CN)3 + 3NH4Cl
S některými látkami reaguje za vzniku komplexů, meziproduktem pro jejich vznik však je příslušný kyanid.
S halogenderiváty uhlovodíků vytváří nitrily (kyanidy). Takto reagují i kyanid draselný a kyanid sodný. Příkladem je reakce jodmethanu s kyanidem amonným, při které vzniká jodid amonný a acetonitril (methylkyanid):
CH3I + NH4CN → CH3CN + NH4I
Reaguje s ketony a aldehydy za vzniku slotučenin majících aminoskupinu a kyanoskupinu. Dojde na jejich navázání namísto kyslíku v ketonové (případně aldehydové) skupině C=O. Příkladem je reakce s dimethylketonem (acetonem):
CH3COCH3 + NH4CN → CH3NH2CCNCH2CH3 + H2O
Využití
Kyanid amonný se používá na organické syntézy a na výrobu kyanidů a kyanidových komplexů.
Bezpečnost
Při požití kyanid amonný reaguje s kyselinou chlorovodíkovou v žaludku za vzniku kyseliny kyanovodíkové, který se vstřebává žaludeční stěnou do krve. Kyanovodík následně zablokuje enzymy buněčného dýchání. Zásoba ATP v buňkách je prakticky okamžitě vypotřebována, dochází tedy k zastavení biochemických procesů, a smrti. Předpokládaje, že krevní oběh roznese vzniklý kyanovodík do celého těla do 5 sekund, zástava srdce nastává asi za 10 sekund a dochází ke smrti.
Měření přítomnosti látky
Na zjištění koncentrace kyanidu amonného v roztoku je možno použít argentometrickou titraci, jsou-li však přítomny v roztoku halogenidy (fluoridy, chloridy, bromidy či jodidy), dochází ke znehodnocení výsledků.
Reference
V tomto článku byl použit překlad textu z článku Ammonium cyanide na anglické Wikipedii.
Externí odkazy
 Obrázky, zvuky či videa k tématu Kyanid amonný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Kyanid amonný na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Symbol of pollutants to the environment, according to the directive 67/548/EWG of 'European Chemicals Bureau (European Chemicals Agency).
Structure of the cyanide ion