Kyanid měďný
| Kyanid měďný | |
|---|---|
 Struktura | |
| Obecné | |
| Systematický název | kyanid měďný |
| Funkční vzorec | CuCN |
| Sumární vzorec | CCuN |
| Vzhled | bílý prášek |
| Identifikace | |
| Registrační číslo CAS | 544-92-3 |
| EC-no (EINECS/ELINCS/NLP) | 208-883-6 |
| PubChem | 11009 |
| SMILES | [Cu+].[C-]#N |
| InChI | 1S/CN.Cu/c1-2;/q-1;+1 |
| Vlastnosti | |
| Molární hmotnost | 89,563 g/mol |
| Teplota tání | 474 °C (747 K)[1] |
| Teplota varu | rozkládá se[1] |
| Hustota | 2,92 g/cm3[1] |
| Rozpustnost ve vodě | nerozpustný[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v kyselině chlorovodíkové a vodném roztoku kyanidu draselného nebo amoniaku, nerozpustný v ethanolu[1] |
| Tlak páry | 0,13 kPa (572 °C)[1] |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H300 H310 H330 H400 H410[1] |
| P-věty | P260 P262 P264 P270 P271 P273 P280 P284 P301+310 P302+350 P304+340 P310 P320 P321 P322 P330 P361 P363 P391 P403+233 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Kyanid měďný je anorganická sloučenina se vzorcem CuCN. Používá se jako katalyzátor, při pokovování mědi, a při přípravě nitrilů.[2]
Struktura
Kyanid měďný má polymerní strukturu. Vyskytuje se ve dvou polymorfních formách, které obě obsahují řetězce -[Cu-CN]- tvořené Cu centry propojené kyanidovými ligandy. Vysokoteplotní polymorf má strukturu podobnou kyanidu stříbrnému, lineární řetězec zaujímá tvar šestiúhelníku a sousední řetězce jsou posunuty o +/- 1/3 c.[3] U nízkoteplotního polymorfu řetězec není lineární a tvoří rozvlněné vrstvy, které se na sebe skládají, pootočené o 49°.[4]
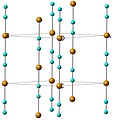
Struktura vysokoteplotního polymorfu kyanidu měďného s řetězci rotujícíni kolem osy c; oranžová = měď, modrá = kyanidové ionty
Struktura nízkoteplotního polymorfu kyanidu měďného; oranžová = měď, modrá = kyanidové ionty
Nízkoteplotní polymorf lze přeměnit na vysokoteplotní zahřátím na 563 K (290 °C) v inertní atmosféře. U obou polymorfů mají vazby Cu-C délku 185 pm.[5]
Příprava
Kyanid měďný lze zakoupit jako nízkoteplotní polymorf. Připravuje se redukcí síranu měďnatého hydrogensiřičitanem sodným za teploty 60 °C a následné reakce produktu s kyanidem sodným.[6]
- 2 CuSO4 + NaHSO3 + H2O + 2 NaCN → 2 CuCN + 3 NaHSO4
Po přidání hydrogensiřičitanu sodného roztok síranu měďnatého změní barvu na zelenou a přidá se kyanid sodný. Reakce se provádí v mírně kyselém prostředí. V minulosti se kyanid měďný připravoval přímou reakcí síranu měďnatého s kyanidem sodným, kdy také vznikal dikyan:[7]
- 2 CuSO4 + 4 NaCN → 2 CuCN + (CN)2 + 2 Na2SO4
Tvorba dikyanu při této reakci způsobovala nedostatečnou čistotu takto připraveného kyanidu, a proto se tento postup v průmyslu nepoužívá.
Podobným způsobem lze připravit jodid měďný, čímž se projevují vlastnosti kyanidového aniontu odpovídající pseudohalogenidům, a lze tak také vysvětlit, proč nebyl připraven kyanid měďnatý.
Reakce
Kyanid měďný je ve vodě nerozpustný, avšak rozpouští se snadno v roztocích kyanidů za vzniku komplexů [Cu(CN)3]2− a [Cu(CN)4]3−, čímž se liší od kyanidu stříbrného a zlatného, které tvoří ionty [M(CN)2]−.[8]
Použití
Kyanid měďný se používá při pokovovávání mědi.[2]
Organická syntéza
CuCN reaguje s organolithnými sloučeninami za vzniku smíšených solí se vzorci Li[RCuCN] a Li2[R2CuCN]. Použitím CuCN došlo ke zjednodušení přípravy organoměďných činidel typu CuR a LiCuR2, nazývaných Gilmanova činidla.
Uvedené smíšené soli jsou zdroji karboaniontů, méně reaktivní než organolithné sloučeniny. Díky tomu je lze využít například v konjugovaných adicích.
Kyanid měďnatý může být také použit na přípravu stanylových a silylových sloučenin, používaných jako zdroje R3Sn− a R3Si−.[9]
Kyanid měďný se používá na přeměnu arylhalogenidů na nitrily.[10]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Copper(I) cyanide na anglické Wikipedii.
- ↑ a b c d e f g h i j Copper(I) cyanide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b H. Wayne Richardson "Copper Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. DOI:10.1002/14356007.a07_567
- ↑ S. J. Hibble; S. M. Cheyne; A. C. Hannon; S. G. Eversfield. CuCN: A Polymorphic Matirial. Structure of One Form from Total Neutron Diffraction. Inorganic Chemistry. 2002, s. 8040–8048.
- ↑ S. J. Hibble; S. G. Eversfield; A. R. Cowley; A. M. Chippindale. Copper(I) Cyanide: A Simple Compound with a complicated Structure and Surprising Room-Temperature Reactivity. Angewandte Chemie International Edition. 2004, s. 628–630.
- ↑ S. Kroeker; R. E. Wasylishen; J. V. Hanna. The Structure of Solid Copper(I) Cyanide: A Multinuclear Magnetic and Quadrupole Resonance Study. Journal of the American Chemical Society. 1999, s. 1582–1590.
- ↑ H. J. Barber. Cuprous Cyanide: A Note on its Preparation and Use. Journal of the American Chemical Society. 1943, s. 79.
- ↑ J. V. SUPNIEWSKI AND P. L. SALZBERG. Allyl Cyanide. Org. Synth.. 1941. Dostupné online. (anglicky); Coll. Vol.. S. 46. (anglicky)
- ↑ A. G. Sharpe. The Chemistry of Cyano Complexes of the Transition Metals. [s.l.]: Academic Press, 1976. ISBN 0-12-638450-9. S. 265.
- ↑ Dieter, R. K. In Modern Organocopper Chemistry; Krause, N., Ed.; Wiley-VCH: Mörlenback, Germany, 2002; Chapter 3.
- ↑ Steven H. Bertz, Edward H. Fairchild, Karl Dieter, "Copper(I) Cyanide" in Encyclopedia of Reagents for Organic Synthesis 2005, John Wiley & Sons. DOI:10.1002/047084289X.rc224.pub2
Externí odkazy
 Obrázky, zvuky či videa k tématu Kyanid měďný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Kyanid měďný na Wikimedia Commons - National Pollutant Inventory - Cyanide compounds fact sheet
- National Pollutant Inventory - Copper and compounds fact sheet
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Autor: Bilbe85, Licence: CC BY 3.0
Shows the structure of LT-CuCN down the a axis. Key orange = copper, cyan = both carbon and nitrogen atoms the cyanide groups can be regarded as showing head-to-tail disorder. Appropriately 2 unit cells are shown.
Ball-and-stick model of the unit cell of the alpha polymorph of copper(I) cyanide, α-CuCN.
Colour code:
- Copper, Cu: orange-pink
- Carbon, C: pink
- Nitrogen, N: pink
The orientations of the cyanide ions in the linear (CuCN)∞ chains are disordered, so it is not possible to distinguish carbon from nitrogen in the crystal structure.
Crystal structure from Inorg. Chem. (2002) 41, 4990–4992.
Model constructed and image generated in CrystalMaker 8.1.Autor: Bilbe85, Licence: CC BY 3.0
The structure of HT-CuCN. Key copper = orange, cyan = disordered cyanide groups.