Kyselina askorbová
| kyselina L-askorbová | |
|---|---|
 | |
 | |
| Obecné | |
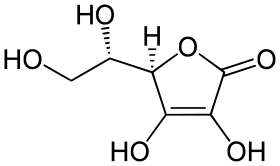
| Systematický název | L-threo-hex-2-enono-1,4-lakton; (5R)-5-[(1S)-1,2-dihydroxyethyl]-3,4-dihydroxyfuran-2(5H)-on |
| Ostatní názvy | lakton L-3-ketothreohexuronové kyseliny; antiscorb; vitamín C |
| Latinský název | Acidum ascorbicum |
| Sumární vzorec | C6H8O6 |
| Identifikace | |
| Registrační číslo CAS | 50-81-7 |
| PubChem | 5785 |
| ChEBI | 29073 |
| SMILES | C([C@@H]([C@@H]1C(=C(C(=O)O1)O)O)O)O |
| Vlastnosti | |
| Molární hmotnost | 176,12 g/mol |
| Teplota tání | 190 až 192 °C |
| Hustota | 1,65 g/cm3 |
| Rozpustnost ve vodě | 330 g/l (voda) |
Některá data mohou pocházet z datové položky. | |
Kyselina askorbová nebo také kyselina L-askorbová, označovaná jako vitamin C, je ve vodě rozpustná organická sloučenina s redukčními účinky, v pevném stavu bílého vzhledu; znečištěná s možným nažloutlým zabarvením. Představuje derivát glukózy, z něhož řada zvířat dokáže danou aktivní látku vyrábět. Člověk ji stejně jako další primáti, morče domácí, ryby z nadřádu kostnatí, netopýři a někteří ptáci, není schopen syntetizovat v důsledku absence L-gulonolaktonoxidázové aktivity a musí ji přijímat v potravě.[1] Řadí se mezi vitamíny rozpustné ve vodě, v níž vytváří slabě kyselý roztok. V organizmu působí jako důležitý antioxidant.
V ATC klasifikaci léčiv patří do farmakoteraputické skupiny Vitaminy, kód: A11GA01.[2]
Historie
Maďarský biochemik Albert Szent-Györgyi získal v roce 1937 Nobelovu cenu za fyziologii nebo lékařství „za objevy v oblasti biologického spalovacího procesu, zvláště ve vztahu k vitamínu C a katalýze kyseliny fumarové.“[3][4]
Již mezi roky 1918–1923 uvedli první zprávy o charakteru a izolaci látky Zilva a Hardena. Roku 1928 pak Szent-Györgyi izoloval kyselinu hexuronovou z nadledvin a papriky, aby byla následně potvrzena strukturní shoda s „redukčním faktorem“ Zilvy. Walter Haworth,[5] Edmund Hirst[6] a Tadeus Reichstein paralelně syntetizovali redukční faktor a potvrdili původně navržený model sloučeniny Karrerem, Micheelem a Kraftem. Pro hexuronovou kyselinu, neboli antiskorbutický faktor, použil Szent-Györgyi nový název kyselina askorbová v důsledku jeho léčebných účinků skorbutu.[7][4][8]
Šest let po objevu vitamínů biochemikem polského původu Kazimierzem Funkem zavedl v roce 1919 Jack Cecil Drummond termín „ve vodě rozpustný C“. Kyselina askorbová je ve volné přírodě přítomna také ve vázané formě jako „askorbigén“, jenž ze zelí roku 1956 získal Procházka. V moderní době přísluší daný termín jen jedné z forem kyseliny v rostlinné čeledi brukvovité (Brassicaceae).[8]
Etymologický původ má „kyselina askorbová“ v latinských: a (nepřítomnost) + scorbutus (kurděje – onemocnění při deficitu vitamínu C).
Chemické a biochemické vlastnosti
Kyselina askorbová se účastní tvorby žlučových kyselin a v metabolismu pojivových tkání hydroxyluje aminokyseliny lysin a prolin v kolagenu.[9] Stejně tak podporuje začleňování síranů do mukopolysacharidů. Zapojuje se do syntézy karnitinu, derivátu lysinu a methioninu, a ovlivňuje beta-oxidaci mastných kyselin. Zvyšuje aktivitu mikrosomálních enzymů.

Askorbáty jsou soli odvozené od relativně silné kyseliny askorbové v redukované formě koenzymu. Ten hraje roli také v degradaci aminokyseliny tyrosinu, čímž se účastní metabolismu katecholaminů – adrenalinu, noradrenalinu a dopaminu. Snadná oxidace molekuly na kyselinu dehydroaskorbovou – tedy oxidovanou formou, způsobuje její výrazné redukční účinky.[9]
Kyselina askorbová je schopna vázat reaktivní formy kyslíku, čímž snižuje rozvoj aterosklérozy a zhoršeného prokrvení tkání, omezuje peroxidaci lipidů a profylakticky působí před cigaretovými oxidanty. Podílí se na menší přilnavosti krevních destiček a bílých krvinek na endotelu stěny cév. Podporuje proces hojení.[2]
V rámci biotransformace urychluje detoxikaci cizorodých látek a přispívá ke zvyšování imunity. LD50 při perorálním podání u myši činí 3 367 mg/kg.[10] Cytotoxický účinek by mohl spočívat v aktivaci DNázy a ničení DNA rakovinných buněk.[2]
Znehodnocení kyseliny askorbové nastává v kontaktu s kovy či varem.
V přírodě se nevyskytující diastereomer, kyselina D-isoaskorbová (erythorbová), používaná jako syntetický konzervant (E315), má co do biologické aktivity účinnosti kyseliny L-askorbové (u morčete domácího).[11]
Hladina v krevní plazmě
Doporučená denní dávka pro dospělého jedince je 100 mg[12] (90 mg muži/80 mg ženy podle EFSA).[13][14] Klinické příznaky snížené hladiny v plazmě se objevují při hodnotách ≤ 10 μmol/l, za indikátor nízkého přívodu vitaminu C jsou považovány hodnoty pod 37 μmol/l. Z hlediska prevence aterosklerózy a nádorů se za žádoucí považují hodnoty ≥ 50 μmol/l. Projevy nadbytku z potravy nejsou uváděny.[15] Přibližně 1 % nevyužitého vitamínu C se transformuje na kyselinu šťavelovou. Riziko tvorby ledvinových kamenů je u zdravých osob nízké. Denní příjem by neměl překročit 1 000 mg. Podávání velmi vysokých dávek (přes 5 g) může způsobit průjem.
Reference
- V tomto článku byl použit překlad textu z článku Ascorbic acid na anglické Wikipedii.
- V tomto článku je použit text článku Kyselina askorbová ve WikiSkriptech českých a slovenských lékařských fakult zapojených v MEFANETu.
- ↑ LACHAPELLE, M. Y.; DROUIN, G. Inactivation dates of the human and guinea pig vitamin C genes. Genetica. 2010, s. 199–207. DOI 10.1007/s10709-010-9537-x. PMID 21140195. (anglicky)
- ↑ a b c Souhrn údajů o přípravku: ACIDUM ASCORBICUM Biotika [online]. Státní ústav pro kontrolu léčiv [cit. 2016-06-20]. Dostupné online.
- ↑ The Nobel Prize in Physiology or Medicine 1937 [online]. Nobel Foundation [cit. 2007-07-28]. Dostupné online.
- ↑ a b SCHOTT, Heinz. Kronika medicíny. Praha: Fortuna Print, 1994. ISBN 80-85873-16-8. Kapitola 1928, s. 419.
- ↑ Story of Vitamin C's chemical discovery. Profiles.nlm.nih.gov; přístup: 2012-12-04
- ↑ DAVIES, Michael B.; AUSTIN, John; PARTRIDGE, David A. Vitamin C: Its Chemistry and Biochemistry. [s.l.]: The Royal Society of Chemistry, 1991. ISBN 0-85186-333-7. S. 48. (anglicky)
- ↑ SVIRBELF, Joseph Louis; SZENT-GYÖRGYI, Albert. The Chemical Nature Of Vitamin C. [s.l.]: National Library of Medicine collection, 25-04-1932. Dostupné online. (anglicky).
- ↑ a b VÁVROVÁ, Jaroslava. Vitamín C: Historie [online]. Nemocnice s poliklinikou Karviná-Ráj [cit. 2016-06-20]. Dostupné v archivu pořízeném dne 2016-08-25.
- ↑ a b KOOLMAN, Jan; RÖHM, Klaus-Heinrich. Barevný atlas biochemie [online]. překlad 4. vydání. vyd. Praha: Grada Publishing, 2012. Kapitola Enzymy, s. 86. ISBN 978-80-2472977-0.
- ↑ Substance Name: Ascorbic acid [USP:INN:BAN:JAN] [online]. Toxicology Data Network [cit. 2016-06-20]. Dostupné online.
- ↑ GOLDMAN, H M; GOULD, B S; MUNRO, H N. The antiscorbutic action of l-ascorbic acid and d-isoascorbic acid (erythorbic acid) in the guinea pig. S. 24–33. The American Journal of Clinical Nutrition [online]. 1981-01. Roč. 34, čís. 1, s. 24–33. DOI 10.1093/ajcn/34.1.24.
- ↑ Referenzwerte für die Nährstoffzufuhr (DACH) [online]. první. vyd. Frankfurt am Main: Umschau/Braus, 2000. ISBN 3-8295-7114-3.
- ↑ Pomáhá vitamin C proti nachlazení?. Plzeň [online]. 2018-12-07 [cit. 2021-02-17]. Dostupné online.
- ↑ Scientific Opinion on Dietary Reference Values for vitamin C. EFSA Journal. 2013, roč. 11, čís. 11, s. 3418. Dostupné online [cit. 2021-02-17]. ISSN 1831-4732. DOI 10.2903/j.efsa.2013.3418. (anglicky) Archivováno 14. 1. 2021 na Wayback Machine.
- ↑ Remedia Compendium, Vitamin C. [s.l.]: Panax, 1996. ISBN 80-902126-1-1. S. 406.
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina askorbová na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina askorbová na Wikimedia Commons
Média použitá na této stránce
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Structure of L-semidehydroascorbic acid
L-ascorbic acid
Ball-and-stick model of the L-ascorbic acid (vitamin C) molecule, C6H8O6, as found in the crystal structure.
X-ray diffraction data from J. Mol. Struct.: THEOCHEM (1997) 419, 139-154.
Model constructed in CrystalMaker 8.1.
Image generated in Accelrys DS Visualizer.Synthesis of ascorbic acid (according to Reichstein or Heyns respectively)








