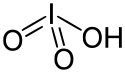
Kyselina jodičná
| Kyselina jodičná | |
|---|---|
 | |
 | |
 | |
| Obecné | |
| Systematický název | Kyselina jodičná |
| Anglický název | Iodic acid |
| Německý název | Iodsäure |
| Sumární vzorec | HIO3 |
| Vzhled | Bílá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 7782-68-5 |
| Vlastnosti | |
| Molární hmotnost | 175,911 g/mol |
| Teplota tání | 110 °C |
| Teplota rozkladu | 110 °C |
| Hustota | 4,629 g/cm³ (0 °C) 4,650 4 g/cm³ (25 °C) |
| Disociační konstanta pKa | 0,858 (20 °C) |
| Rozpustnost ve vodě | 286 g/100 g (0 °C) 310 g/100 g (16 °C) 473 g/100 g (80 °C) 576 g/100 g (101 °C) |
| Struktura | |
| Krystalová struktura | Polymorfní Kosočtverečná |
| Hrana krystalové mřížky | Kosočtverečná a= 553 pm b= 592 pm c= 775 pm |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R8, R34 |
| S-věty | S17, S26, S36/37/39, S45 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Kyselina jodičná je bílá krystalická látka velmi dobře rozpustná ve vodě na bezbarvý až slabě nažloutlý roztok. Patří mezi středně silné kyseliny (1% roztok má pH = 3).
Její soli se nazývají jodičnany, nejvýznamnější je jodičnan draselný, který se přidává do soli pro zvýšení obsahu jodu.
Příprava
1. Oxidací jódu kyselinou dusičnou:
- 3I2 + 10HNO3 → 6HIO3 + 10NO + 2H2O
2. Oxidací jódu chlórem ve vodném roztoku:
- I2 + 5Cl2 + 6H2O → 2HIO3 + 10HCl
V roztoku oxiduje redukční činidla za vzniku jódu. Kyselina jodičná tvoří dva typy solí, a to jodičnany (MIO3) a hydrogenjodičnany (MIO3.H IO3 a MIO3.2H IO3). Jodičnany jsou stálejší než chlorečnany a bromičnany, ale jsou také oxidačními činidly. Připravujeme je oxidací jodidů v zásaditém roztoku nebo rozpouštěním jódu v alkalických louzích.
Reference
- ↑ a b Iodic acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina jodičná na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina jodičná na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Iodic acid; Monoiodic acid