Kyselina nitrosylsírová
| Kyselina nitrosylsírová | |
|---|---|
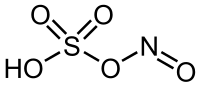 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | kyselina nitrosylsírová |
| Sumární vzorec | HNO5S |
| Vzhled | světle žluté krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 7782-78-7 |
| EC-no (EINECS/ELINCS/NLP) | 231-964-2 |
| PubChem | 82157 |
| SMILES | N(=O)OS(=O)(=O)O |
| InChI | 1S/HNO5S/c2-1-6-7(3,4)5/h(H,3,4,5) |
| Vlastnosti | |
| Molární hmotnost | 127,08 g/mol |
| Teplota tání | 73,5 °C (346,6 K)[2] |
| Teplota varu | rozkládá se |
| Rozpustnost ve vodě | rozkládá se |
| Rozpustnost v polárních rozpouštědlech | rozpustná v kyselině sírové[1] |
| Bezpečnost | |
| [2] Nebezpečí[2] | |
| H-věty | H271 H272 H301 H311 H314 H331[2] |
| P-věty | P210 P220 P221 P260 P261 P264 H270 P280 P283 P301+310 P301+330+331 P302+352 P303+361+353 P304+340 P305+351+338 P306+360 P310 P311 P312 P321 P322 P330 P361 P363 P370+378 P371+380+375 P403+233 P405 P501[2] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Kyselina nitrosylsírová je anorganická sloučenina se vzorcem NOHSO4. Jedná se o bezbarvou kapalinu používanou na výrobu kaprolaktamu,[3] která se také používala k výrobě kyseliny sírové. Jedná se o smíšený anhydrid kyseliny sírové a dusičné.
V organické chemii slouží k nitrosylacím a jako diazotační a oxidační činidlo.[1]
Příprava a reakce
Kyselina nitrosylsírová se vyrábí rozpouštěním dusitanu sodného v chladné kyselině sírové:[4][5]
- HNO2 + H2SO4 → NOHSO4 + H2O
Také ji lze získat reakcí kyseliny dusičné s oxidem siřičitým.[6]
Kyselina nitrosylsírová je zde meziproduktem při přípravě chloridu nitrosylu (NOCl).
NOHSO4 se používá k přípravě diazoniových solí z aminů Sandmeyerovou reakcí. Podobnými zdroji nitrososkupiny jsou tetrafluorboritan nitrosonia ([NO]BF4) a chlorid nitrosylu.
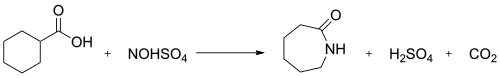
V průmyslu slouží nitrosodekarboxylační reakce kyseliny nitrosylsírové a cyklohexankarboxylové k výrobě kaprolaktamu:[3]
Reference
V tomto článku byl použit překlad textu z článku Nitrosylsulfuric acid na anglické Wikipedii.
- ↑ a b c George A. Olah, G. K. Surya Prakash, Qi Wang, Xing-Ya Li. Nitrosylsulfuric Acid. [s.l.]: [s.n.], 2001. ISBN 978-0471936237. DOI 10.1002/047084289X.rn060. (anglicky)
- ↑ a b c d e Nitrosylsulfuric acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b J. Ritz; H. Fuchs; H. Kieczka; W. C. Moran. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2002. ISBN 978-3527306732. DOI 10.1002/14356007.a05_031. Kapitola Caprolactam.
- ↑ HODGSON, H. H.; MAHADEVAN, A. P.; WARD, E. R. 1,4-Dinitronaphthalene. Org. Synth.. 1955. Dostupné online. (anglicky); Coll. Vol.. S. 341. (anglicky)
- ↑ SANDIN, R. B.; CAIRNS, T. L. 1,2,3-Triiodo-5-nitrobenzene. Org. Synth.. 1943. Dostupné online. (anglicky); Coll. Vol.. S. 604. (anglicky)
- ↑ G. H. Coleman; G. A. Lillis; G. E. Goheen. Nitrosyl Chloride. [s.l.]: [s.n.], 1939. ISBN 9780470132326. DOI 10.1002/9780470132326.ch20. S. 55–59.
Externí odkazy
 Obrázky, zvuky či videa k tématu Kyselina nitrosylsírová na Wikimedia Commons
Obrázky, zvuky či videa k tématu Kyselina nitrosylsírová na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Autor: PointlessUsername, Licence: CC BY-SA 4.0
Synthesis of caprolactam by the nitrosodecarboxylation of cyclohexanecarboxylic acid by nitrosylsulfuric acid
Autor: Jynto (more from this user), Licence: CC0
Ball-and-stick model of the nitrosylsulfuric acid molecule, a compound used to produce caprolactam.
Barevný kód:- Vodík, H: bílá
- Kyslík, O: červená
- Dusík, N: modrá
- Síra, S: žlutá