Kyselina propionová
| Kyselina propionová | |
|---|---|
 | |
| Obecné | |
| Systematický název | propanová kyselina |
| Latinský název | acidum propionicum; acidum propanoicum |
| Anglický název | propionic acid |
| Německý název | Propionsäure |
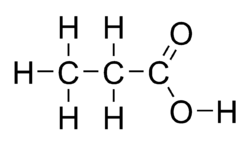
| Sumární vzorec | C3H6O2 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 79-09-4 |
| EC-no (EINECS/ELINCS/NLP) | 201-176-3 |
| Indexové číslo | 607-089-00-0 |
| Číslo RTECS | UE5950000 |
| Vlastnosti | |
| Molární hmotnost | 74,08 g/mol |
| Teplota tání | −21 °C, 252 K |
| Teplota varu | 141 °C, 414 K |
| Hustota | 0,99 g/cm3 |
| Viskozita | 10 mPa.s |
| Disociační konstanta pKa | 4,88 |
| Rozpustnost ve vodě | mísitelná |
| Struktura | |
| Dipólový moment | 0,63 D |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H314 |
| R-věty | R34 |
| S-věty | (S1) S23 S36 S45 |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Kyselina propionová (lat. acidum propionicum, též propanoicum nebo methylaceticum, systematický název propanová kyselina) je přirozeně se vyskytující karboxylová kyselina s chemickým vzorcem CH3CH2COOH. V čistém stavu jde o bezbarvou kapalinu s dráždivým zápachem. Anion CH3CH2COO− a příslušné soli a estery kyseliny propionové jsou známy jako propionáty (nebo propanoáty).
Historie
Kyselinu propionovou poprvé popsal Johann Gottlieb (1815–1875) v roce 1844, kdy ji objevil v degradačních produktech cukru. V dalších letech získávají jiní chemici tuto kyselinu různými dalšími cestami, aniž by si některý z nich uvědomil, že produkuje tuto látku. V roce 1847 prokázal francouzský chemik Jean-Baptiste Dumas, že všechny tyto kyseliny byly toutéž sloučeninou, kterou nazval kyselinou propionovou podle řeckých slov protos = „první“ a pion = „tuk“, protože to byla kyselina s nejmenší molekulou H(CH2)nCOOH, která vykazovala vlastnosti mastných kyselin, například tvorbu olejovité vrstvy při vysolování z vody, nebo že má mýdlovitou draselnou sůl.
Vlastnosti
Kyselina propionová má fyzikální vlastnosti na pomezí mezi nižšími karboxylovými kyselinami, kyselinou mravenčí a octovou, a vyššími (mastnými kyselinami). Je mísitelná s vodou, ale lze ji odstranit z vody přidáním soli. Stejně jako kyselina octová či mravenčí sestává z vodíkově vázaných párů molekul, jak ve fázi kapalné, tak plynné.
Kyselina propionová vykazuje obecné vlastnosti karboxylových kyselin: může tvořit amidy, estery, anhydridy, a chloridové deriváty. Může podléhat alfa-halogenaci bromem za přítomnosti bromidu fosforitého jako katalyzátoru (HVZ reakce), kdy vzniká CH3CHBrCOOH.[2]
Výroba
Průmyslově se kyselina propionová vyrábí hydrokarboxylací ethylenu pomocí karbonylu niklu jakožto katalyzátoru[3]:
Jiným používaným způsobem je vzdušná oxidace propionaldehydu. Za přítomnosti kobaltu nebo manganu tato reakce probíhá rychle už při teplotách 40–50 °C:
Velká množství kyseliny propionové se získávala jako vedlejší produkt při výrobě kyseliny octové. Aktuálně je největším světovým výrobcem kyseliny propionové firma BASF s 80 tisíci tun ročně.
Biologicky vzniká kyselina propionová v podobě koenzymu A esteru, propionyl-CoA, metabolickým štěpením mastných kyselin obsahujících sudý počet uhlíkových atomů a také štěpením některých aminokyselin. Bakterie rodu Propionibacterium produkují kyselinu propionovou jako konečný produkt svého anaerobního metabolismu. Tato skupina bakterií se běžně vyskytuje v žaludku přežvýkavců a v potních žlázách člověka (bakterie Propionibacterium acnes), jejich aktivita je částečně odpovědná za pach potu a švýcarského sýra.
Použití
Kyselina propionová v koncentraci 0,1 až 1 % (hmotnostně) inhibuje růst plísní a některých bakterií. Proto se většina této kyseliny spotřebuje jako konzervant potravin a krmiva. V krmivu se používá přímo nebo jako amonná sůl. Do krmiva pro skot se přidává antibiotikum Monensin, aby se v bachoru podpořily bakterie Propionibacterium oproti bakteriím octového kvašení. Tím vzniká méně oxidu uhličitého a krmivo se lépe využije. Takto vznikne zhruba polovina veškeré světové produkce kyseliny propionové. Jinou velkou oblastí použití je konzervace pečiva, kdy se používá sodná nebo vápenatá sůl[3].
Kyselina propionová a její soli (E280 až E283) u pokusných myší vedly k přibývání na váze ke vzniku inzulinové rezistence.[4]
Kyselina propionová je užitečná také jako meziprodukt pro výrobu dalších chemikálií, zejména polymerů. Acetát-propionát celulózy je užitečný termoplast. Používá se také vinylpropionát. Ze specializovanějších aplikací lze zmínit výrobu pesticidů a léčiv. Estery kyseliny propionové mají ovocnou vůni a někdy se používají jako rozpouštědla nebo umělé příchutě[3].
Metabolismus
Metabolismus kyseliny propionové začíná konverzí na propionylkoenzym A (propionyl-CoA), obvyklý první krok metabolismu karboxylových kyselin. Protože v molekule kyseliny propionové jsou tři atomy uhlíku, propionyl-CoA nemůže přímo vstoupit do beta-oxidace ani do Krebsova cyklu. U většiny obratlovců se propionyl-CoA karboxyluje na D-methylmalonyl-CoA, který je izomerem L-methylmalonyl-CoA. Enzym závislý na vitaminu B12 katalyzuje přesmyk L-methylmalonyl-CoA na sukcinyl-CoA, který je meziproduktem v citrátovém (Krebsově) cyklu a může do něj tedy snadno vstoupit.
Při propionové acidemii vystupuje kyselina propionová jako metabolický toxin v jaterních buňkách tím, že se akumuluje v mitochondriích jako propionyl-CoA nebo jeho derivát methylcitrát, dva inhibitory cyklu trikarboxylových kyselin. Propionát se metabolizuje oxidačně v gliích, což naznačuje astrocytovou zranitelnost při propionové acidemii, pokud se může akumulovat vnitromitochondriální propionyl-CoA. Propionová acidemie může měnit jak neuronální, tak gliální expresi genů ovlivněním acetylace histonů[5][6]. U hlodavců kyselina proprionová způsobuje reverzibilní chování připomínající autismus, např. hyperaktivitu a dystonii[5].
Výskyt u člověka
Lidská kůže je hostitelem druhu bakterií známého jako Propionibacterium acnes, nesoucího název podle schopnosti produkovat kyselinu propionovou. Tato bakterie žije hlavně v kožních mazových žlázách a je jednou z hlavních příčin vzniku akné.
Reference
V tomto článku byl použit překlad textu z článku Propionic acid na anglické Wikipedii.
- ↑ a b Propionic acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ C. S. Marvel; V. du Vigneaud. α-bromo-Isovaleric acid. [s.l.]: [s.n.], 1943.
- ↑ a b c W. Bertleff, M. Roeper, X. Sava, “Carbonylation” in Ullmann’s Encyclopedia of Chemical Technology Wiley-VCH: Weinheim, 2003. DOI: 10.1002/14356007.a05 217.
- ↑ Může trvanlivé pečivo za cukrovku a obezitu? Myši ztloustly po oblíbených „éčkách“
- ↑ a b D. F. MacFabe, D. P. Cain, K. Rodriguez-Capote, A. E. Franklin, J. E. Hoffman, F. Boon, A. R. Taylor, M. Kavaliers and K.-P. Ossenkopp. Neurobiological effects of intraventricular propionic acid in rats: Possible role of short-chain fatty acids on the pathogenesis and characteristics of autism spectrum disorders. Behavioral Brain Research. 2007, roč. 176, čís. 1, s. 149–169. doi:10.1016/j.bbr.2006.07.025.
- ↑ N. H. T. Nguyen, C. Morland, S. Villa Gonzalez, F. Rise, J. Storm-Mathisen, V. Gundersen, B. Hassel. Propionate increases neuronal histone acetylation, but is metabolized oxidatively by gli. Relevance for propionic acidemia. Journal of Neurochemistry. 2007, roč. 101, čís. 3, s. 806–814. doi:10.1111/j.1471-4159.2006.04397.x.
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina propionová na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina propionová na Wikimedia Commons - NIST Standard Reference Database
- European Chemicals Bureau
- International Chemical Safety Card 0806
- NIOSH Pocket Guide to Chemical Hazards
- Technical data of propionic acid of BASF
Média použitá na této stránce
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances




