Kyselina trifluorperoctová
| Kyselina trifluorperoctová | |
|---|---|
 Strukturní vzorec | |
| Obecné | |
| Systematický název | kyselina trifluorperoxoethanová |
| Ostatní názvy | kyselina trifluorperoxooctová, kyselina trifluorperoxyoctová |
| Funkční vzorec | CF3C(O)OOH |
| Sumární vzorec | C2HF3O3 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 534-17-8 |
| PubChem | 10290812 |
| SMILES | C(=O)(C(F)(F)F)OO |
| InChI | 1/C2HF3O3/c3-2(4,5)1(6)8-7/h7H |
| Vlastnosti | |
| Molární hmotnost | 130,02 g/mol |
| Teplota varu | 162 °C (435 K) |
| Rozpustnost ve vodě | reaguje |
| Rozpustnost v polárních rozpouštědlech | rozpustná v sulfolanu a acetonitrilu |
| Rozpustnost v nepolárních rozpouštědlech | rozpustná v dichlormethanu a diethyletheru |
Některá data mohou pocházet z datové položky. | |
Kyselina trifluorperoctová je peroxokyselina odvozená od kyseliny trifluoroctové. Jedná se o silné oxidační činidlo, používané v organické chemii například při Baeyerově–Villigerově oxidaci ketonů.[1] Je nejreaktivnější ze všech organických peroxokyselin, což umožňuje oxidaci i poměrně málo reaktivních alkenů na epoxidy, kdy jsou ostatní peroxokyseliny neúčinné.[2] Lze ji také použít k oxidaci chalkogenů v některých funkčních skupinách, například při přeměně selenoetherů na selenony (selenových ekvivalentů thioetherů na ekvivalenty sulfonů).[3] Kyselina peroctová je potenciálně výbušná[4] a není komerčně dostupná, ovšem lze ji rychle připravit před použitím.[5] Její laboratorní používání zavedl a rozvinul William Emmons.[6][7]
Vlastnosti
Při standardní teplotě a tlaku je kyselina trifluorperoctová bezbarvou kapalinou s teplotou varu 162 °C.[8] Rozpouští se v acetonitrilu, dichlormethanu, diethyletheru a sulfolanu a s vodou reaguje.[5] Stejně jako ostatní peroxokyseliny je potenciálně výbušnou látkou.[4] Není komerčně dostupná, ovšem lze ji skladovat několik týdnů za teploty −20 °C.[5] Při některých postupech přípravy této kyseliny se používá směs peroxidu vodíku a kyseliny trifluoroctové, jejíž zahřívání je nebezpečné; peroxid vodíku lze rozložit pomocí oxidu manganičitého.[5][8]
Příprava
Kyselinu trifluorperoctovou je možné rychle připravit reakcí anhydridu kyseliny trifluoroctové s koncentrovaným (90%)[2] vodným roztokem peroxidu vodíku:
- CF3COOCOCF3 + H2O2 → CF3COOOH + CF3COOH
Jelikož se anhydrid při kontaktu s vodou mění na kyselinu trifluoroctovou, tak jeho přebytek slouží též k odstranění vody z peroxidu.:[9]
- CF3COOCOCF3 + H2O → 2 CF3COOH
K přípravě kyseliny trifluorperoctové z kyseliny trifluoroctové lze použít i zředěnější (30%) roztok peroxidu vodíku:[2]
- CF3COOH + H2O2 → CF3COOOH + H2O
Za účelem omezení nebezpečnosti skladování čistého či vysoce koncentrovaného peroxidu vodíku se často používá jeho směs s močovinou.[5] Při tomto postupu se nepoužívá voda, takže vzniká bezvodá kyselina,[10] čímž se zamezí vedlejším reakcím, které za její přítomnosti často probíhají.[11]
- CF3COOCOCF3 + H2O2·CO(NH2)2 → CF3COOOH + CO(NH2)2
Pokud je při přípravě nutné použití pufru a přítomnost vody není na závadu, tak se používá jiný postup. Reakcí anhydridu kyseliny trifluoroctové s peruhličitanem sodným vzniká kyselina trifluorperoctová a uhličitan sodný, díky němuž není potřeba přidávat další pufr.[5][12]
- 3 CF3COOCOCF3 + 4 Na2CO3·1½ H2O2 → 6 CF3COOOH + 4 Na2CO3 + 3 H2O
Použití

Kyselina trifluorperoctová se používá převážně jako oxidační činidlo.[5][7] V září 1953 byla publikována práce Williama Emmonse a Arthura Ferrise, v níž bylo uvedeno, jak tato látka, vytvořená in situ, oxiduje anilin na nitrobenzen.[13] Během následujících dvou let popsal Emmons přípravu tohoto činidla a vytvořil šest dalších prací, ve kterých popisoval jeho použití.;[14][15][16] Emmons je považován za průkopníka[6][7] používání kyseliny trifluorperoctové, která je užitečným činidlem v mnoha druzích syntetzických reakcí, v laboratořích.
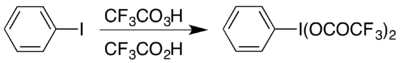
Příkladem použití může být vznik (bis(trifluoracetoxy)jod)benzenu (C6H5I(OOCCF3)2), který se používá k provedení Hofmannova přesmyku v kyselém prostředí.[17] Zmíněná sloučenina obsahuje hypervalentní jod a lze ji získat dvěma způsoby; výběr konkrétního způsobu záleží na dostupných materiálech: výměnnou reakcí jejího acetátového analogu[18] nebo reakcí jodbenzenu se směsí kyseliny trifluorperoctové a trifluoroctové.[17]
Baeyerova–Villigerova oxidace

Kyselina trifluorperoctová je jedním z nejsilnějších činidel používaných při Baeyerově–Villigerově oxidaci, jelikož má vysokou kyselost srovnatelnou s obdobnými kyselinami a peroxidy.[19] Při této reakci, pojmenované podle Adolfovi von Baeyer a Victoru Villigerovi, kteří ji roku 1899 objevili,[1] se acyklické ketony oxidují na estery a cyklické ketony na laktony. Tato reakce má dobrou regioselektivitu a chemoselektivitu na místě, kde se objeví nový kyslíkový atom, a zachovává stereochemii na sousedním atomu, což je zobrazeno na následujícím obrázku. Do reakční směsi se přidává hydrogenfosforečnan sodný (Na2PO4) jako pufr[2] za účelem zabránění hydrolýze, kterou by způsobila vysoce kyselá kyselina trifluoroctová,[20] nebo transesterifikaci.[21] vzniklého esteru.

Epoxidace
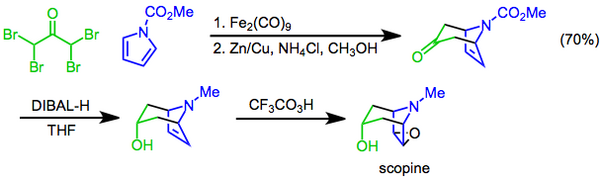
Při Priležajevově reakci,[22] spočívá v přeměně alkenu na epoxid při použití peroxokyseliny jako oxidačního činidla.[23] Příkladem může být syntéza tropanového alkaloidu skopinu, kdy je epoxidace kyslinou trifluorperoctovou závěrečným krokem následujícím po [4+3] cykloadici a diastereomerní redukcí hydridem diisobutylhlinitým.[24]
Vysoká reaktivita kyseliny trifluorperoctové oproti ostatním peroxokyselinám umožňuje účinně oxidovat alkeny a cykloalkeny s poměrně nízkou elektronovou hustotou, jako jsou mimo jiné hex-1-en a α,β-nenasycené estery (například methylmethakrylát), což jsou substráty, které většinou odolávají epoxidaci peroxidovými kyselinami.[2] Přidáním další pufrované kyseliny trifluoroctové do reakční směsi způsobuje vytvoření vicinální hydroxytrifluoracetátové struktury namísto epoxidu. Takovýto produkt lze převést na diol reakcí s methanolem v kyselém prostředí jako například při následující přeměně dodec-1-enu na dodekan-1,2-diol.[2]

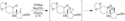
Při použití derivátu allylalkoholu s alkoholovou skupinou v sousedství karbonylu může u epoxidu dojít k rozšíření cyklu za vzniku dioxolanu.[5][11] Proces znázorněný na následujícím obrázku byl použit jako součást totální syntézy neosporolu:[11][25]

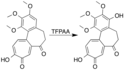
Postup přípravy izomerní sloučeniny sporolu zahrnuje podobnou tvorbu dioxolanu. Během tohoto procesu se používá kyselina trifluorperoctová vytvořená z peroxidu vodíku, který může obsahovat stopová množství vody, která vede ke vzniku poloacetalu místo dioxolanu. Je-li k získání kyseliny použit komplex močoviny, z nějž vzniká čistá kyselina, pak je dioxolan hlavním produktem tohoto procesu.[11] Vytvořený dioxolan lze rozšířit na 1,3-dioxanovou skupinu přítomnou ve sporolu v dalším kroku syntézy.[25]
Oxidace heteroatomu
Funkční skupiny obsahující heteroatomy v nižších oxidačních číslech lze zoxidovat kyselinou trifluorperoctovou.[5] Často se takto oxiduje jod (příkladem je výše uvedená příprava sloučeniny s hypervalentním jodem z jodbenzenu), dusík, síra nebo selen.
U dusíkatých sloučenin lze uvést oxidaci oximů[5] a primárních aromatických aminů[15] na příslušné nitrosloučeniny[7] (i za přítomnosti substituentů snižujících elektronovou hustotu); například pentafluoranilin se oxiduje na pentafluornitrobenzen,[26] nitrosaminy na nitraminy,[7][14] dají se takto připravit aromatické N a azin-N-oxidy,[5][27] a nitrososloučeniny lze tímto způsobem zoxidovat na nitrosloučeniny či nitraminy.[5]
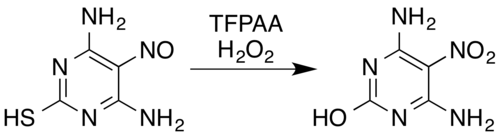
Například nitrososubstituovaný derivát pyrimidinu 4,6-diamino-5-nitrosopyrimidin-2-thiol se oxiduje na nitrosloučeninu směsí peroxidu vodíku a kyseliny trifluorperoctové, přičemž se rovněž odštěpuje thiolová skupina oxidačně hydrolytickou desulfurací.[5][28]
Sulfidové skupiny (R1SR2) lze kyselinou trifluorperoctovou oxidovat, v závislosti na reakčních podmínkách, na sulfoxidy (R1–S(O)–R2) a/nebo sulfony (R1–S(O)2–R2).[5] Selenoethery (R1–Se–R2) se podobně oxidují na selenony (R1–Se(O)2–R2), zde ovšem nedochází k tvorbě selenoxidů, tedy analogů sulfoxidů, v izolovatelné podobě,[3] tato reakce je obzvláště účinná, pokud je R1 a/nebo R2 arylová skupina.
Sulfinylchloridy (RS(O)Cl) se vyrábí reakcí odpovídajícího thiolu s chloridem sulfurylu SO2Cl2. Pokud místo toho vznikne sulfenylchlorid (RSCl), tak se přidá kyselina trifluorperoctová, jež umožní vznik požadovaného sulfinylchloridu. Na následujícím obrázku je zobrazena syntéza 2,2,2-trifluor-1,1-difenylethanthiolu:[29]

U oxidace thiofenu kyselinou trifluorperoctovou dochází k „soutěžení“ různých reakčních mechanismů a může tak vzniknout produkt S oxidace i epoxidace.[30][31][32][33] Hlavním mechanismem vzniká sulfoxid, který ovšem podstupuje dimerizaci Dielsova–Alderova typu předtím než může dojít k oxidaci; mezi produkty reakce nebyly nalezeny thiofen-S-oxid ani thiofen-S,S-dioxid.[5][30] Dimer lze následně dále oxidovat a převést tak jednu z S-oxidových skupin na S,S-dioxid. Ve vedlejším mechanismu dochází k Priležajevově epoxidaci,[23] jejímž produktem je thiofen-2-on.[30] Bylo prokázáno, že epoxidace zde není vedlejší reakcí S-oxidového meziproduktu[34] a pomocí izotopového značkování bylo zjištěno, že dochází k 1,2-hydridovému posunu a uvolňuje se kationtový meziprodukt.[30] Použití kyseliny trifluorperoctové je při této reakci výhodné, protože přítomná voda omezuje průběh vedlejšího reakčního mechanismu.[30]

Oxidace se zásaditým přesmykem
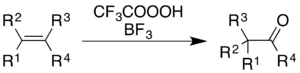
Pomocí směsi kyseliny trifluorperoctové a fluoridu boritého (sloužícího jako katalyzátor) lze oxidovat alkeny a areny za současného molekulového přesmyku na „kostře“ molekuly.[5]
U alkenů dochází k epoxidaci následované Wagnerovým–Meerweinovým přesmykem katalyzovaným BF3:[35]
Podobná oxidace aromatické sloučeniny, konkrétně oxidace 1,2,3,4,5,6-hexamethylbenzenu na 2,3,4,5,6,6-hexamethyl-2,4-cyklohexadienon, je znázorněna na následujícím obrázku:

Oxidační štěpení arenů
Kromě samotné oxidace aromatických sloučenin na sloučeniny karbonylové může být kyselina trifluorperoctová použita rovněž ke štěpení vazeb mezi uhlíkovými atomy v aromatickém kruhu. Na rozdíl od jiných oxidací alkylaromatických látek, při nichž štěpením alkylového řetězce na benzylu vzniká kyselina benzoová nebo podobné látky, zde dochází k „obrácené oxidaci“, přičemž se štěpí samotné aromatické jádro.[36][37]

Tato selektivita u některých typů vazeb umožňuje rozklad složitých směsí uhlovodíků, jako je například uhlí, za účelem zjištění jejich struktury.[38][36]
U heterocyklických aromatických sloučenin k tomuto druhu štěpení nedochází kvůli přednostní oxidaci heteroatomů a deaktivaci aromatického kruhu vůči elektrofilním reakcím s peroxykyselinami; například pyridiny, puriny a chinoliny místo toho vytvářejí N-oxidy,[5] zatímco sirné heterocykly jako oktafluordibenzothiofen se přeměňují na sulfony.[7][39]
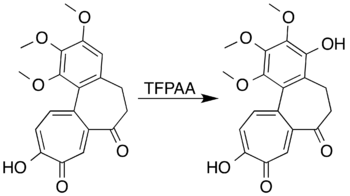
Aromatické sloučeniny obsahující aktivující substituenty mohou být zoxidovány na fenoly a otevírání aromatického kruhu u nich nenastává, například mesitylen reaguje s kyselinou trifluorperoctovou za vzniku mesitolu (2,4,6-trimethylfenolu).[7] Při pokusech o přípravu laktonu Baeyerovou–Villigerovou oxidací 7-oxodeacetamidokolchicinu se nepodařilo získat požadovaný produkt, ovšem došlo k oxidaci aromatického kruhu za vzniku fenolové sloučeniny, a to s vysokou výtěžností.[5][40]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Trifluoroperacetic acid na anglické Wikipedii.
- ↑ a b KÜRTI, László; CZAKÓ, Barbara. Strategic Applications of Named Reactions in Organic Synthesis. [s.l.]: Elsevier Academic Press, 2005. ISBN 9780124297852. S. 28. (anglicky)
- ↑ a b c d e f HIYAMA, Tamejiro. Organofluorine Compounds: Chemistry and Applications. [s.l.]: Springer Science & Business Media, 2000. Dostupné online. ISBN 9783662041642. Kapitola 8.2 Trifluoroacetic acid and Trifluoroperacetic acid, s. 255–257. (anglicky)
- ↑ a b KATAOKA, T.; YOSHIMATSU, M. Synthesis: Carbon with One Heteroatom Attached by a Single Bond. Redakce Ley Steven V.. [s.l.]: Elsevier, 1995. (Comprehensive Organic Functional Group Transformations). Dostupné online. ISBN 9780080423234. Kapitola Alkyl Chalcogenides: Selenium- and Tellurium-based Functional Groups, s. 277–296. (anglicky)
- ↑ a b CAREY, Francis A.; SUNDBERG, Richard J. Advanced Organic Chemistry: Part A: Structure and Mechanisms. 5th. vyd. [s.l.]: Springer Science & Business Media, 2007. Dostupné online. ISBN 9780387448978. Kapitola 5.5 Addition Reactions Involving Epoxides, s. 503–514. (anglicky)
- ↑ a b c d e f g h i j k l m n o p q r CASTER, Kenneth C.; RAO, A. Somasekar; MOHAN, H. Rama; MCGRATH, Nicholas A.; BRICHACEK, Matthew. e-EROS Encyclopedia of Reagents for Organic Synthesis. Trifluoroperacetic Acid. [s.l.]: [s.n.], 2012. DOI 10.1002/047084289X.rt254.pub2. (anglicky)
- ↑ a b FREEMAN, Jeremiah P. William D. Emmons: November 18, 1924 – December 8, 2001. Organic Syntheses. November 14, 2002, s. xxvii–xxix. Dostupné online. (anglicky) Archivovaná kopie. www.orgsyn.org [online]. [cit. 2018-12-13]. Dostupné v archivu pořízeném z originálu dne 2015-03-16.
- ↑ a b c d e f g CHAMBERS, Richard D. Fluorine in Organic Chemistry. [s.l.]: CRC Press, 2004. Dostupné online. ISBN 9780849317903. Kapitola Functional Compounds Containing Oxygen, Sulphur or Nitrogen and their Derivatives, s. 242–243. (anglicky)
- ↑ a b LUXON, S. G. Hazards in the Chemical Laboratory. 5th. vyd. [s.l.]: Royal Society of Chemistry, 1992. ISBN 9780851862293. S. 627. (anglicky)
- ↑ HART, Harold; LANGE, Richard M.; COLLINS, Peter M. 2,3,4,5,6,6-Hexamethyl-2,4-cyclohexadien-1-one. Org. Synth.. 1968, s. 87. Dostupné online. DOI 10.15227/orgsyn.048.0087. (anglicky); Coll. Vol.. S. 598. (anglicky)
- ↑ COOPER, Mark S.; HEANEY, Harry; NEWBOLD, Amanda J.; SANDERSON, William R. Oxidation Reactions Using Urea–Hydrogen Peroxide; A Safe Alternative to Anhydrous Hydrogen Peroxide. Synlett. 1990, s. 533–535. DOI 10.1055/s-1990-21156. (anglicky)
- ↑ a b c d ZIEGLER, Fredrick E.; METCALF, Chester A.; NANGIA, Ashwini; SCHULTE, Gayle. Structure and total synthesis of sporol and neosporol. Journal of the American Chemical Society. 1993, s. 2581–2589. DOI 10.1021/ja00060a006. (anglicky)
- ↑ KANG, Ho-Jung; JEONG, Hee-Sun. New Method of Generating Trifluoroperoxyacetic acid for the Baeyer-Villiger Reaction. Bull. Korean Chem. Soc.. 1996, s. 5–6. Dostupné online. (anglicky)
- ↑ EMMONS, William D.; FERRIS, Arthur F. Oxidation Reactions with Pertrifluoroacetic Acid. Journal of the American Chemical Society. 1953, s. 4623–4624. DOI 10.1021/ja01114a539. (anglicky)
- ↑ a b EMMONS, William D. Peroxytrifluoroacetic Acid. I. The Oxidation of Nitrosamines to Nitramines. Journal of the American Chemical Society. 1954, s. 3468–3470. DOI 10.1021/ja01642a029. (anglicky)
- ↑ a b EMMONS, William D. Peroxytrifluoroacetic Acid. II. The Oxidation of Anilines to Nitrobenzenes. Journal of the American Chemical Society. 1954, s. 3470–3472. DOI 10.1021/ja01642a030. (anglicky)
- ↑ EMMONS, William D.; PAGANO, Angelo S.; FREEMAN, Jeremiah P. Peroxytrifluoroacetic Acid. III. The Hydroxylation of Olefins. Journal of the American Chemical Society. 1954, s. 3472–3474. DOI 10.1021/ja01642a031. (anglicky)
EMMONS, William D.; PAGANO, Angelo S. Peroxytrifluoroacetic Acid. IV. The Epoxidation of Olefins. Journal of the American Chemical Society. 1955, s. 89–92. DOI 10.1021/ja01606a029. (anglicky)
EMMONS, William D.; LUCAS, George B. Peroxytrifluoroacetic Acid. V. The Oxidation of Ketones to Esters. Journal of the American Chemical Society. 1955, s. 2287–2288. DOI 10.1021/ja01613a077. (anglicky)
EMMONS, William D.; PAGANO, Angelo S. Peroxytrifluoroacetic Acid. VI. The Oxidation of Oximes to Nitroparaffins. Journal of the American Chemical Society. 1955, s. 4557–4559. DOI 10.1021/ja01622a036. (anglicky) - ↑ a b AUBÉ, Jeffrey; FEHL, Charlie; LIU, Ruzhang; MCLEOD, Michael C.; MOTIWALA, Hashim F. Heteroatom Manipulations. [s.l.]: [s.n.], 1993. (Comprehensive Organic Synthesis II; sv. 6). DOI 10.1016/B978-0-08-097742-3.00623-6. Kapitola 6.15 Hofmann, Curtius, Schmidt, Lossen, and Related Reactions, s. 598–635. (anglicky)
- ↑ ALMOND, M. R.; STIMMEL, J. B.; THOMPSON, E. A.; LOUDON, G. M. Hofmann Rearrangement Under Mildly Acidic Conditions Using [I,I-Bis(Trifluoroacetoxy)]Iodobenzene: Cyclobutylamine Hydrochloride from Cyclobutanecarboxamide. Org. Synth.. 1988, s. 132. Dostupné online. DOI 10.15227/orgsyn.066.0132. (anglicky); Coll. Vol.. S. 132. (anglicky)
- ↑ MYERS, Andrew G. Chemistry 115 Handouts: Oxidation [online]. Harvard University [cit. 2017-01-10]. Dostupné online. (anglicky)
- ↑ CARRUTHERS, William. Some Modern Methods of Organic Synthesis. [s.l.]: Cambridge University Press, 1971. Dostupné online. ISBN 9780521096430. Kapitola 6.3 Oxidation of Olefins, s. 259–280. (anglicky)
- ↑ CARRUTHERS, William. Some Modern Methods of Organic Synthesis. [s.l.]: Cambridge University Press, 1971. Dostupné online. ISBN 9780521096430. Kapitola 6.5 Baeyer–Villiger oxidation of ketones, s. 287–290. (anglicky)
- ↑ PRILESCHAJEW, Nikolaus. Oxydation ungesättigter Verbindungen mittels organischer Superoxyde. Chemische Berichte. 1909, s. 4811–4815. DOI 10.1002/cber.190904204100. (German)
- ↑ a b HAGEN, Timothy J. Name Reactions of Functional Group Transformations. Redakce Li Jie Jack. [s.l.]: John Wiley & Sons, 2007. Dostupné online. ISBN 9780470176504. Kapitola Prilezhaev reaction, s. 274–281. (anglicky)
- ↑ HAYAKAWA, Y.; BABA, Y.; MAKINO, S.; NOYORI, R. Carbon-carbon bond formation promoted by transition metal carbonyls. 19. General synthesis of tropane alkaloids via the polybromo ketone-iron carbonyl reaction. Journal of the American Chemical Society. 1978, s. 1786–1791. DOI 10.1021/ja00474a021. (anglicky)
- ↑ a b Part B: Bicyclic and Tricyclic Sesquiterpenes. Redakce Pirrung Michael C.. [s.l.]: John Wiley & Sons, 2000. (The Total Synthesis of Natural Products; sv. 11). Dostupné online. ISBN 9780470129630. Kapitola 10. Neosporol, Sporol, s. 222–224. (anglicky)
- ↑ BROOKE, G. M.; BURDON, J.; TATLOW, J. C. Aromatic polyfluoro-compounds. Part VII. The reaction of pentafluoronitrobenzene with ammonia. Journal of the Chemical Society. 1961, s. 802–807. DOI 10.1039/JR9610000802. (anglicky)
- ↑ WILLIAMS, W. Michael; DOLBIER, William R. Thermal and photochemical rearrangements of azine oxides. I. Pyrolytic decomposition to nitriles. Journal of Organic Chemistry. 1969, s. 155–157. DOI 10.1021/jo00838a034. (anglicky)
- ↑ TAYLOR, Edward C.; MCKILLOP, Alexander. A New Synthesis of 5-Nitropyrimidines. Journal of Organic Chemistry. 1965, s. 3153–3155. DOI 10.1021/jo01020a067. (anglicky)
- ↑ PAGE, P. C. B.; WILKES, R. D.; REYNOLDS, D. Synthesis: Carbon with One Heteroatom Attached by a Single Bond. Redakce Ley Steven V.. [s.l.]: Elsevier, 1995. (Comprehensive Organic Functional Group Transformations). Dostupné online. ISBN 9780080423234. Kapitola Alkyl Chalcogenides: Sulfur-based Functional Groups, s. 113–276. (anglicky)
- ↑ a b c d e TREIBER, Alexander. Mechanism of the Aromatic Hydroxylation of Thiophene by Acid-Catalyzed Peracid Oxidation. Journal of Organic Chemistry. 2002, s. 7261–7266. DOI 10.1021/jo0202177. (anglicky)
- ↑ MANSUY, Daniel; VALADON, Philippe; ERDELMEIER, Irene; LÓPEZ GARCIA, Pilar; AMAR, Claudine; GIRAULT, Jean-Pierre; DANSETTE, Patrick M. Thiophene S-Oxides as new Reactive Metabolites: Formation by Cytochrome P-450 Dependent Oxidation and Reaction with Nucleophiles. J. Am. Chem. Soc.. 1991, s. 7825–7826. DOI 10.1021/ja00020a089. (anglicky)
- ↑ CORREIA, Maria A.; HOLLENBERG, Paul F. Cytochrome P450: Structure, Mechanism, and Biochemistry. Redakce Ortiz de Montellano Paul R.. 4th. vyd. [s.l.]: Springer Publishing, 2015. Dostupné online. ISBN 9783319121086. Kapitola Inhibition of Cytochrome P450 Enzymes, s. 177–260. (anglicky)
- ↑ MACHEREY, Anne-Christine; DANSETTE, Patrick M. The Practice of Medicinal Chemistry. Redakce Wermuth Camille Georges. 4th. vyd. [s.l.]: Elsevier, 2015. Dostupné online. ISBN 9780124172135. Kapitola Biotransformations Leading to Toxic Metabolites:Chemical Aspects, s. 585–614. (anglicky)
- ↑ ANSLYN, Eric V.; DOUGHERTY, Dennis A. Modern Physical Organic Chemistry. [s.l.]: University Science Books, 2006. Dostupné online. ISBN 9781891389313. Kapitola 8.8 Miscellaneous Experiments for Studying Mechanism, s. 471–482. (anglicky)
- ↑ HART, Harold; LERNER, Lawrence R. Oxidations with peroxytrifluoroacetic acid-boron trifluoride. IX. Direct oxidation of alkenes to ketones using peroxytrifluoroacetic acid–boron fluoride. Journal of Organic Chemistry. 1967, s. 2669–2673. DOI 10.1021/jo01284a004. (anglicky)
- ↑ a b DENO, Norman C.; GREIGGER, Barbara A.; STROUD, Stephen G. New method for elucidating the structures of coal. Fuel. 1978, s. 455–459. DOI 10.1016/0016-2361(78)90153-9. (anglicky)
- ↑ DENO, Norman C.; GREIGGER, Barbara A.; MESSER, Lauren A.; MEYER, Michael D.; STROUD, Stephen G. Aromatic ring oxidation of alkylbenzenes. Tetrahedron Letters. 1977, s. 1703–1704. DOI 10.1016/S0040-4039(01)93253-8. (anglicky)
- ↑ DENO, Norman C.; CURRY, Kenneth W.; GREIGGER, Barbara A.; JONES, A. Daniel; RAKITSKY, Walter G.; SMITH, Karen A.; WAGNER, Karen. Dihydroaromatic structure of Illinois No. 6 Monterey coal. Fuel. 1980, s. 694–698. Dostupné online. DOI 10.1016/0016-2361(80)90021-6. (anglicky)
- ↑ CHAMBERS, R. D.; CUNNINGHAM, J. A.; SPRING, D. J. Polyfluoroaryl organometallic compounds. Part VIII. Synthesis of and nucleophilic substitution in octafluorodibenzofuran. Journal of the Chemical Society C. 1968, s. 1560–1565. DOI 10.1039/J39680001560. (anglicky)
- ↑ BERG, Ulf; BLADHA, Håkan; MPAMPOSA, Konstantinos. Stereochemical variations on the colchicine motif. Peracid oxidation of thiocolchicone. Synthesis, conformation and inhibition of microtubule assembly. Organic and Biomolecular Chemistry. 2004, s. 2125–2130. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina trifluorperoctová na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina trifluorperoctová na Wikimedia Commons
Média použitá na této stránce
Skeletal structures for the oxidative cleavage of propylbenzene. Using hexavalent chromium as the oxidant gives benzoic acid. Using a mixture of hydrogen peroxide and trifluoroacetic acid gives butyric acid.
(bis(trifluoroacetoxy)iodo)benzene-3D-balls
Skeletal structures for the oxidation of the nitroso group of 4,6-diamino-5-nitrosopyrimidine-2-thiol using trifluoroperacetic acid and hydrogen peroxide converts it to a nitro group. Desulfurisation also occurs, converting the thiol group to a hydroxyl.
Reaction of 1-dodecene with trifluoroperacetic acid in the presence of an amine-salt as pH buffer gives a trifluoroacete intermediate, which reacts with methanol in the presence of hydrochloric acid to give a dodecane-1,2-diol.
Generic skeletal structures for the oxidation/rearrangement reaction of an alkene to form a carbonyl using trifluoroperacetic acid and boron trifluoride
Skeletal structures of the oxidation of 7-oxodeacetamidocolchicine using trifluoroperacetic acid produces a phenol.
Structures for the oxidation of hexamethylbenzene using trifluoroperacetic acid with boron trifluoride as an additive. Trifluoroacetic acid is the byproduct.
Skeletal structures for the Baeyer–Villiger oxidation of a chiral β-keto ester using trifluoroperacetic acid, with disodium phosphate as a pH buffer.
w:Thiophene is oxidised by w:trifluoroperacetic acid by two pathways. The major reaction involves the formation of thiophene-S-oxide which undergoes subsequent w:Diels-Alder-style dimerisation and further oxidation. The minor pathway involves the formation of thiophene-2,3-epoxide and subsequent rearrangement to thiophene-2-one. The reaction is discussed in the paper doi: doi:10.1021/jo0202177 and in the w:Encyclopedia of Reagents for Organic Synthesis article at doi: doi:10.1002/047084289X.rt254.pub2 .
The image was extracted and modified from this PDF of the EROS manuscript by w:user:EdChem and uploaded to Wikipedia on the same day. Whilst the EROS content is copyright protected, individual chemical structures and equations are ineligible for such protection.Equation for the conversion of 2,2,2-trifluoro-1,1-diphenylethanethiol F
3C–CPh
2–SH to the corresponding sulfenyl chloride with sulfuryl chloride, and then on to 2,2,2-trifluoro-1,1-diphenylethanesulfinyl chloride, F
3C–CPh
2–S(O)Cl, by trifluoroperacetic acid oxidation.
Reaction of iodobenzene with trifluoroperacetic acid in trifluoroacetic acid gives (Bis(trifluoroacetoxy)iodo)benzene
Autor: OrganicReactions, Licence: CC BY 3.0
Synthesis of scopine via reductive [4+3] cycloaddition
Skeletal structures for an epoxidation of an alkene using trifluoroperacetic acid, followed by an isomerization involving the epoxide and an adjacent ketone to form a 1,3-dioxolane. This reaction is part of a synthesis of neosporol.