Lektiny

Lektiny jsou velká skupina proteinů neimunitního původu, které dokáží s vysokou mírou specifity rozpoznávat a vázat cukry, ať už volné nebo vázané na glykoproteinech nebo glykolipidech. Na rozdíl od glykosyltransferáz lektiny nekatalyzují žádnou chemickou reakci, tedy nevykazují enzymatickou aktivitu. Lektiny se účastní mnoha dějů, ve kterých je nutné specifické rozpoznávání (imunologické reakce, kontakt buněk ve tkáních, interakce patogenů s hostitelem atd.). První objevené lektiny byly pro jejich schopnost aglutinovat (shlukovat, srážet) červené krvinky pojmenovány aglutininy (WGA – wheat germ agglutinin, RCA – Ricinus communis agglutinin).
Dělení lektinů
Lektiny se dají dělit podle zdrojů, ze kterých se získávají, na:
- rostlinné
- živočišné
- houbové
- bakteriální
Rostlinné lektiny
Patří mezi nejčastěji používané v rutinní laboratorní a medicínské praxi. Jsou většinou velmi stálé (v lyofilizované podobě vydrží bez problému několik let) a jsou relativně levné.
Živočišné lektiny
| podskupina | typické sacharidové ligandy | lokalizace | příklady funkcí |
| Calnexiny | Glc1Man9 | ER (endoplasmatické retikulum) | kontrola správného sbalení glykoproteinů v ER |
| M-typ | Man8 | ER | degradace glykoproteinů asociovaná s ER |
| L-typ | různé | ER, GA (Golgiho aparát) | třídění proteinů |
| P-typ | Man-6-fosfát, různé | sekreční cesta (ER, GA, sekreční granule, lysosom) | třídění proteinů z GA, degradace glykoproteinů v ER, |
| C-typ | různé | plasmatická membrána, extracelulární prostor | buněčná adhese (selektiny), vrozená imunita (collectiny), (vazebná aktivita závislá na Ca2+) |
| S-typ (galektiny) | β-D-Gal | cytoplasma, extracelulární prostor | regulace cytoplasmatických dějů (například apoptóza), prokřížení extracelulárních glykoproteinů (aktivita závislá na přítomnosti thiolových skupin –SH) |
| I-typ (siglekty) | sialové kyseliny | plasmatická membrána | buněčná adheze |
| R-typ | různé | GA, plazmatická membrána | třídění enzymů, regulace glykoproteinových hormonů |
| F-box lektiny | (GlcNAc)2 | cytoplasma | degradace špatně sbalených proteinů |
| fikoliny | GlcNAc, GalNAc | plazmatická membrána, extracelulární prostor | vrozená imunita |
| chitináze podobné lektiny | chito-oligosacharidy | extracelulární | metabolismus kolagenu |
| F-typ | oligosacharidy zakončené fukózou | extracelulární | vrozená imunita |
| intelektiny | Gal, galaktofuranóza, pentózy | plazmatická membrána, extracelulární prostor | vrozená imunita, oplodnění, embryogeneze |
Příklady dějů založených na lektinovém rozpoznávání
- třídění proteinů v Golgiho aparátu: enzymy patřící do lyzozomu jsou glykosylovány manóza-6-fosfátem a pomocí P-lektinů zachytávány a zakoncentrovávány v určité části Golgiho aparátu, která po odštěpení dá vzniknout lysozomu
- kalnexin – chaperon, který je schopen rozpoznat špatně sbalené N-glykoproteiny v endoplasmatickém retikulu a zadržet je tam; jsou buď znovu sbaleny nebo degradovány
- E-selektin – je exprimován endoteliálními buňkami v oblasti zánětu. Rozpoznávají určité sialované sacharidy na povrchu některých leukocytů a zpomalují jejich pohyb kapilárou (tzv. kutálení), leukocyty tak mají čas protáhnout se z kapiláry ven a vcestovat do místa zánětu
- bakterie Helicobacter pylori je spojována s mnoha žaludečními chorobami (např. žaludeční vředy); adhezi (přichycení) na žaludeční epitel jí umožňují lektiny, které rozpoznávají sialové kyseliny a L-fukózu
- bakterie Pseudomonas aeruginosa (rezistentní proti řadě antibiotik), nebezpečná pro pacienty trpící cystickou fibrózou, využívá specifické interakce lektinů PA-IIL a PA-IL s povrchovými sacharidy plicního epitelu při kolonizaci plic
Příklady využití lektinů ve vědě a medicíně
- studium sacharidových komponent glykoproteinů a glykolipidů
- izolace biomolekul nebo celých buněk nesoucích určité sacharidové struktury (afinitní chromatografie)
- histologická vyšetření (detekce nádorových buněk)
- aktivace T-lymfocytů (např. ConA); některé lektiny mohou působí jako mitogeny (látky podporující dělení buněk)
- stanovení krevních skupin – příslušné lektiny způsobují aglutinaci jen konkrétních krvinek (podstata krevních skupin tkví v rozdílných glykosylací): DBA reaguje přednostně s A2, LTL s 0, GSL-I B4 s B, ...
- léčba bakteriálních infekcí – inhibice bakteriálních lektinů vhodnými vysokoafinitními inhibitory lze využít při léčbě bakteriálních infekcí (např. podpůrná léčba infekcí močového měchýře pomocí d-manosy, čisticí ušní kapky pro psy a kočky, obsahující směs rhamnosy, galaktosy a manosy)
Příklady lektinů a jimi rozpoznávaných sacharidů
| Zkratka | Latinský název | Český název | Sacharidová specifita (pokud není uvedeno jinak pak[1]) | Poznámky |
| AAA | Allium ascalonicum | cibule šalotka | hlavně sacharidy obsahující koncový trisacharid α–D-Man-(1-6)[α-D-Man(1-3)]-Man[2] | monomer |
| AAL | Aleuria aurantia | mísenka oranžová | L-Fuc | |
| ABA | Agaricus bisporus | pečárka dvouvýtrusá | Gal a β-D-Gal-(1-3)-GalNAc popř. Gal a β-D-Gal-(1-3)-GlcNAc; také GlcNAc na degalaktosylovaných N-glykanech[3] | neváže monosacharidy, homotetramer, má dvě vazebná místa – jedno pro Gal a druhé pro GlcNAc |
| ACA | Amaranthus caudatus | laskavec ocasatý | β-D-Gal-(1-3)-GalNAcα-Ser/Thr | |
| AMA | Arum maculatum | árón plamatý | β-D-Gal-(1,4)-GlcNAc, desializovaný fetuin[4] | |
| AchatininH, (ATNH), | Achatina fulica | oblovka žravá, achatina dravá | úzká specifita pro 9-O-acetylované sialové kyseliny[5] | je schopný vázat červené krvinky a periferními krevními mononuklearními buňkami (B- a T-lymfocyty, NK buňky) u pacientů s akutní lymfoblastickou leukémií[6] |
| AOL | Aspergillus oryzae | - | α-L-Fuc-(1-6) vázaná na jádro N-vázaného oligosacharidu, méně pak α-L-Fuc-(1-2,3,4)[7] | |
| ASA I, ASA III | Allium sativum | česnek kuchyňský | N-glykany s vysokým obsahem manózy[8] | |
| BanLec | Musa x sapientum | banánovník | vnitřní α-D-Glc-(1,3)-Man | |
| BDA | Bryonia dioica | posed dvoudomý | GlcNAc[9] | |
| BPL | Bauhinia purpurea alba | - | β-D-Gal-(1-3)-GalNAc | |
| CCL | Ciborinia camelliae | - | GalNAc | |
| ConA | Canavalia ensiformis | - | α-Manosylové větve (pokud není mezi nimi GlcNAc), glukosylované struktury, hybridní typy a biantenární komplexní typy N-glykanů | metaloprotein, vyžaduje přítomnost Ca2+ nebo Mg 2+, široká specifita, jeden z nejpoužívanějších lektinů, homotetramer |
| DBA | Dolichos biflorus | mína dvoukvětá | α-D-GalNAc-Ser/Thr a α-D-GalNAc(1-3)-GalNAc (Forssmanův disacharid) > α-D-GalNAc-(1-3)[α-L-Fuc-(1-2)-Gal (A-trisacharid)[10] | viz IRA |
| DSA | Datura stramonium | durman obecný | poly-LacNAc a větvené LacNAc | |
| ECA | Erythrina cristagalli | Zarděnice hřebenitá | β-D-Gal-(1-4)-Glc(NAc) | |
| EEL | Euonymus europaeus | brslen evropský | α-D-Gal-(1-3)(α-L-Fuc-(1-2)-Gal | |
| GNA | Galanthus nivalis | sněženka podsněžník | nesubstituované α-D-Man-(1-3)[11] | nerozponává hybridní typ N-glykanů |
| GSL-I | Griffonia simplicifolia | - | α-D-GalNAc, α-D-GalNAc-Ser/Thr) a α-D-Gal | |
| GSL-I A4 | Griffonia simplicifolia | - | GalNAc | |
| GSL-I B4 | Griffonia simplicifolia | - | α-D-Gal | |
| GSL-II | Griffonia simplicifolia | - | GlcNAc a degalaktosylované N-glykany | |
| HHL | Hippeastrum hybrid | hvězdník | nesubstituované, α-D-Man-(1-6) a α-D-Man-(1-3), některé galaktomanany z kvasinek[12] | homotetramer, na rozdíl od ConA neváže glukosylované struktury, nerozponává hybridní typ N-glykanů |
| HPA | Helix pomatia | hlemýžď zahradní | GalNAc[13] | viz IRA |
| IRA | Iris x hollandica | α-D-GalNAc-(1-3,6)-D-Gal (A-disacharid)[10] | má jiné preference než podobné lektiny: PLA (α-D-GalNAc-(1-3)[α-L-Fuc-(1-2)-Gal(A-trisacharid)], DBA (α-D-GalNAc-(1-3)-D-GalNAc > A-trisacharid), RCA a HPA mají širší spektrum vázaných sacharidů[10] | |
| jacalin (AIL) | Artocarpus integrifolia | chlebovník | β-D-Gal-(1-3)-α-D-GalNAc-Ser/Thr a α-D-GalNAc-Ser/Thr | |
| LABA | Laburnum anagyroides | štědřenec odvislý (zlatý déšť) | nejvíc:α-L-Fuc-(1-2)- β-D-Gal-(1-4)-D-Glc, také: α-L-Fuc-(1-2)-D-Gal, α-L-Fuc-(1-2)- β-D-Gal-(1-4)[-α-L-Fuc-(1-3)]-D-Glc, nejméně pak samotná L-Fuc[14] | |
| LCA | Lens culinaris | čočka | α-L-Fuc-(1-6)-GlcNAc, manosové řetězce | metaloprotein, vyžaduje přítomnost Ca2+ nebo Mg 2+, užší specifita než Con A |
| LEL | Lycopersicon esculentum | rajče jedlé | poly-LacNAc a (GlcNAc)n a N-glykany s vysokým obsahem manosy[15] | |
| LFA | Limax flavus (Limacus flavus) | slimák pestrý | sialové kyseliny[16] | |
| LTL (LTA1) | Lotus tetragonolobus (Tetragonolobus purpureus) | ledenec nachový | α-L-Fuc-(1-3)-GlcNAc, Sia-Lex, and Lex (= β-D-Gal-(1-4)-[ α-L-Fuc-( 1-3)]- β-D-GlcNAc -(1-3)-R),[17][18] α-L-Fuc-(1-6)-GlcNAc,[19] velmi špatně váže α-L-Fuc-(1-2) | v literatuře není úplná jednota k specifitě tohoto lektinu, podobné vazebné vlastnosti jako UEA-I[20] |
| MAL (MAL I) | Maackia amurensis | makie amurská | α-D-Sia-(2-3)-β-D-Gal-(1-4)-Glc(NAc) | izolace pomocí afinitní chromatografie na vepřovém thyroglobulinu[21] |
| MAH (MAL II) | Maackia amurensis | makie amurská | α-D-Sia-(2-3)-Gal | specifická pro α-D-Sia-(2-3), lze porovnat s SNA (který má specifitu α-D-Sia-(2-3)),[22] izolace pomocí afinitní chromatografie na vepřovém thyroglobulinu[21] |
| ML-I (VAA-I,viscumin) | Viscum album | jmelí bílé | α-D-Neu5Ac(Sia)-(2-6)-β-D-Gal-(1-4)-Glc(NAc)[23] | |
| MOA | Marasmius oreadus | špička obecná | Gal | |
| MPA | Maclura pomifera | maklura jablkonosná | β-D-Gal(1-3)-α-D-GalNAc-Ser/Thr a α-D-GalNAc-Ser/Thr | |
| NPA | Narcissus pseudonarcissus | narcis obecný | nesubstituované α-D-Man-(1-6)[12] | |
| PAA (PSA, PAL, PSL) | Peziza arvernesis (Peziza sylvestris) | řasnatka lesní (houba) | D-arabinóza[24] | |
| PHA-E | Phaseolus vulgaris | fazol obecný | tetraantenární komplexní N-glykany | |
| PHA-L | Phaseolus vulgaris | fazol obecný | vmezeřený (bisecting) GlcNAc a biantenarní (dvouvětvé) N-glykany | |
| PLA | Phaseolus limensis (Phaseolus lunatus) | fazol měsíční | α-D-GalNAc-(1-3)[α-L-Fuc-(1-2)]-Gal(A-trisacharid)[10] | viz IRA |
| PNA | Arachis hypogaea | podzemnice olejná | β-D-Gal-(1-3)-α-D-GalNAc-Ser/Thr (T-antigen) | |
| PTL-I | Physocarpus tetragonolobus | tavola | α-D-GalNAc a Gal | |
| PSA | Pisum sativum | hrách setý | α-L-Fuc-(1-6)-GlcNAc | |
| PSL | Polyporus squamosus | choroš šupinatý | vysoce specifický k α-D-Sia-(2-6)-β-D-Gal-(1-4)-Glc(NAc)[25] | v literatuře není ještě plně zavedená zkratka, občas může být označen PSA |
| PVL | Psathyrella velutina | křehutka sametová | GlcNAc, koncová NeuNAc-(2-3)-Gal[26] | |
| PWM | Phytolacca americana | líčidlo americké | Poly-LacNAc a (GlcNAc)n | |
| RCA120 | Ricinus communis | skočec obecný | β-D-Gal-(1-4)-GlcNAc | |
| RPbAI,II | Robinia pseudoacacia | trnovník akát | GalNAc[27] | |
| RSL | Ralstonia solanacearum | - | α-L-Fuc(1-2)-Gal a α-L-Fuc(1-6)-Gal; méně pak α-L-Fuc(1-3/4)-Gal, výrazně méně (5-6x) rozpoznává D-Ara a L-Gal[28] | |
| SBA | Glycine max | sója | GalNAc (obzvláště koncové α-D-GalNAc-(1-3)-Gal) | |
| ScLL | Synadenium carinatum | - | D-Gal | |
| SNA(b) | Sambucus nigra | bez černý | α-D-Sia-(2-6)-β-D-Gal-(1-4)-Glc(NAc),[29] α-D-Sia-(2-6)-β-D-Gal(NAc)[22] | získává se z kůry bezu; je specifický k α-D-Sia-(2-6) vazbě, lze jej doplnit lektinem MAL II, který je specifický pro α-D-Sia-(2-3), schopnost nebo zvýšení vazby tohoto lektinu na buňky je možným ukazatelem jejich nekrózy nebo apoptózy[22], izolace pomocí afinitní chromatografie na hovězím fetuinu[30] |
| SSA | Sambucus sieboldiana | bez Sieboldův | α-D-Sia-(2-6)-β-D-Gal-(1-4)-Glc(NAc) | |
| STL | Solanum tuberosum | lilek brambor | větvené i lineární poly-LacNAc a (GlcNAc)n[31] | STL je glykoprotein bohatý na arabinózu |
| TJA-I | Trichosanthes japonica | - | α-D-Sia-(2-6)-β-D-Gal-(1-4)-Glc(NAc) a β-D-Gal-(1-4)-Glc(NAc) | |
| TJA-II | Trichosanthes japonica | - | β-D-GalNAc a α-L-Fuc-(1-2)-Gal | |
| UDA | Urtica dioica | kopřiva dvoudomá | Poly-LacNAc a (GlcNAc)n | |
| UEA-I | Ulex europaeus | hlodáš evropský | hlavně α-L-Fuc-(1-2) (např.α-L-Fuc-(1-2)-β-D-Gal-(1-4)-Glc(NAc))[18] | výborný marker pro endotheliální buňky, podobný lektinu LTL[20] |
| VVA | Vicia villosa | vikev huňatá | GalNAc and α-D-GalNAc-Ser/Thr (Tn-antigen) | |
| WFA | Wisteria floribunda | vistárie mnohokvětá | koncové GalNAc (např. β-D-GalNAc-(1-4)-GlcNAc | |
| WGA | Triticum vulgaris | pšenice | multivalentní Sia a (GlcNAc)n |
| Glc | ConA, BanLec, |
| GlcNAc | ABA, BDA, GSL-II, PVL, WGA |
| Gal | ABA, ACA, AMA, BPL, ECA, GSL-I, jacalin, MPA, PNA, PTN-I, RCA, ScLL, TJA-I |
| GalNAc | CCL, DBA, GSL-I, GSL-IA4, HPA, jacalin, MPA, PTN-I, RPbA-I, II, SBA, TJA-II, VVA, WFA |
| Fuc | AAL, AOL, EEL, LABA, LCA, LTL, PSA, RSL, TJA-II, UEA-I |
| Man | AAA,ASA I, ASA III, ConA, GNA, HHL, LCA, NPA |
| Sia | AchatininH, LFA, MAL, MAH, ML-I, PSL, PVL, SNA, SSA, TJA-I, WGA |
| Ara | PAA,RSL |
| LacNAc | DSA, LCA, PWM, STL,UDA, |
| s vysokým obsahem manózy | ConA, LCA |
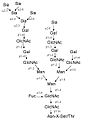
Galerie sacharidů
- Sialovaný LacNAc s 1-6 vázanou L-Fuc
- triantenární N-glykan bohatý na manózu
- vmezeřený (bisecting) GlcNAc
Odkazy
Reference
- ↑ Tateno H, Uchiyama N, Kuno A, Togayachi A, Sato T, Narimatsu H, Hirabayashi J."A novel strategy for mammalian cell surface glycome profiling using lectin microarray." Glycobiology. 2007 Oct;17(10):1138-46. Epub 2007 Aug 10.
- ↑ „Purification and characterization of a mannose-specific lectin from Shallot (Allium ascalonicum) bulbs.“; Mo H, Van Damme EJ, Peumans WJ, Goldstein IJ.; Arch Biochem Biophys. 1993 Nov 1;306(2):431-8
- ↑ „Evidence that Agaricus bisporus agglutinin (ABA) has dual sugar-binding specificity“; Nakamura-Tsuruta S, Kominami J, Kuno A, Hirabayashi J.; Biochem Biophys Res Commun. 2006 Aug 18;347(1):215-20. Epub 2006 Jun 21
- ↑ „Purification and characterization of an N-acetyllactosamine-specific lectin from tubers of Arum maculatum“; Allen AK.; Biochim Biophys Acta. 1995 May 11;1244(1):129-32.
- ↑ “O-acetylated sialic acid as a distinct marker for differentiation between several leukemia erythrocytes.“; Sen G, Chowdhury M, Mandal C.; Mol Cell Biochem. 1994 Jul 13;136(1):65-70.
- ↑ “O-acetyl sialic acid binding lectin as a probe for detection of subtle change on cell surface induced during acute lymphoblastic leukemia (ALL) and its clinical application.“ Mandal C, Sinha D, Sharma V, Bhattacharya DK.; Indian J Biochem Biophys. 1997 Feb-Apr;34(1-2):82-6.
- ↑ “Carbohydrate binding specificity of a fucose-specific lectin from Aspergillus oryzae: a novel probe for core Fuchse“ Matsumura K, Higashida K, Ishida H, Hata Y, Yamamoto K, Shigeta M, Mizuno-Horikawa Y, Wang X, Miyoshi E, Gu J, Taniguchi N.; J Biol Chem. 2007 May 25;282(21):15700-8. Epub 2007 Mar 23
- ↑ Dam TK, Bachhawat K, Rani PG, Surolia A."Garlic (Allium sativum) lectins bind to high mannose oligosaccharide chains."J Biol Chem. 1998 Mar 6;273(10):5528-35.
- ↑ “A lectin from Bryonia dioica root stocks“ ;Peumans WJ, Nsimba-Lubaki M, Carlier AR, Van Driessche E; Planta; Volume 160, Number 3 / March, 1984; p: 222-228
- ↑ a b c d “Isolation and characterization of an N-acetyl-D-galactosamine-binding lectin from Dutch Iris bulbs which recognizes the blood group A disaccharide (GalNAc alpha 1-3Gal).“; Mo H, Van Damme EJ, Peumans WJ, Goldstein IJ.; J Biol Chem. 1994 Mar 11;269(10):7666-73.
- ↑ “Binding properties of a mannose-specific lectin from the snowdrop (Galanthus nivalis) bulb.“; Shibuya N, Goldstein IJ, Van Damme EJ, Peumans WJ.; J Biol Chem. 1988 Jan 15;263(2):728-34
- ↑ a b „Carbohydrate-binding specificity of the daffodil (Narcissus pseudonarcissus) and amaryllis (Hippeastrum hybr.) bulb lectins.“; Kaku H, Van Damme EJ, Peumans WJ, Goldstein IJ. ;Arch Biochem Biophys. 1990 Jun;279(2):298-304
- ↑ "Biochemical and structural analysis of Helix pomatia agglutinin. A hexameric lectin with a novel fold";Sanchez JF, Lescar J, Chazalet V, Audfray A, Gagnon J, Alvarez R, Breton C, Imberty A, Mitchell EP;J Biol Chem. 2006 Jul 21;281(29):20171-80. Epub 2006 May 16
- ↑ “Interaction of the Laburnum anagyroides lectin with fucoantigens“; Piskarev VE, Bushueva TL, Iamskov IA.; Bioorg Khim. 2007 Jan-Feb;33(1):182-6
- ↑ Oguri S, "Analysis of sugar chain-binding specificity of tomato lectin using lectin blot: recognition of high mannose-type N-glycans produced by plants and yeast."Glycoconj J. 2005 Nov;22(7-9):453-61.
- ↑ „Binding Determinants of the Sialic Acid-specific Lectin from the Slug Limax flavus”; Knibbs RN, Osborne SE, Glick GD, Goldstein IJ; J Biol Chem. 1993 Sep 5;268(25):18524-31.
- ↑ “Immobilized Lotus tetragonolobus agglutinin binds oligosaccharides containing the Lex determinant „;Liying Yan, Patricia P Wilkins, Gerardo Alvarez-Manilla, Su-Il Do, David F Smith and Richard D Cummings; Glycoconjugate Journal; Volume 14, Number 1 / January, 1997,p: 45-55
- ↑ a b "A simple procedure for the isolation of L-fucose-binding lectins from Ulex europaeus and Lotus tetragonolobus",Allen HJ, Johnson EA,Carbohydr Res. 1977 Oct;58(2):253-65
- ↑ “The affinity of the fucose-binding lectin from Lotus tetragonolobus for glycopeptides and oligosaccharides accumulating in fucosidosis.“; JEAN Susz JP, Dawson G; J Neurochem. 1979 Mar;32(3):1009-13
- ↑ a b "A comparison of the binding specificities of lectins from Ulex europaeus and Lotus tetragonolobus."Allen HJ, Johnson EA, Matta KL, Immunol Commun. 1977;6(6):585-602
- ↑ a b "Studies on hemagglutinins from Maackia amurensis seeds." Kawaguchi T, Matsumoto I, Osawa T, J Biol Chem. 1974 May 10;249(9):2786-92
- ↑ a b c „Exposure of {alpha}2,6-sialylated lactosaminic chains marks apoptotic and necrotic death in different cell types“; Malagolini N, Chiricolo M, Marini M, Dall'olio F.; Glycobiology. 2008 Nov 6
- ↑ "Mistletoe lectin I is a sialic acid-specific lectin with strict preference to gangliosides and glycoproteins with terminal Neu5Ac alpha 2-6Gal beta 1-4GlcNAc residues";Müthing J, Meisen I, Bulau P, Langer M, Witthohn K, Lentzen H, Neumann U, Peter-Katalinić J;Biochemistry. 2004 Mar 23;43(11):2996-3007
- ↑ “First report of an arabinose-specific fungal lectin.“; Wang H, Ng TB.; Biochem Biophys Res Commun. 2005 Nov 18;337(2):621-5. Epub 2005 Sep 23
- ↑ “Purification and characterization of a Neu5Acalpha2-6Galbeta1-4Glc/GlcNAc-specific lectin from the fruiting body of the polypore mushroom Polyporus squamosus. „J Biol Chem. 2000 Apr 7;275(14):10623-9 ; Mo H, Winter HC, Goldstein IJ.
- ↑ Ueda H, Matsumoto H, Takahashi N, Ogawa H.,Psathyrella velutina Mushroom Lectin Exhibits High Affinity toward Sialoglycoproteins Possessing Terminal N-Acetylneuraminic Acid alpha 2,3-Linked to Penultimate Galactose Residues of Trisialyl N-Glycans. Comparison with other sialic acid-specific lectins.J Biol Chem. 2002 Jul 12;277(28):24916-25. Epub 2002 May 1
- ↑ "The bark of Robinia pseudoacacia contains a complex mixture of lectins.Characterization of the proteins and the cDNA clones";Van Damme EJ, Barre A, Smeets K, Torrekens S, Van Leuven F, Rougé P, Peumans WJ;Plant Physiol. 1995 Mar;107(3):833-43.
- ↑ "The fucose-binding lectin from Ralstonia solanacearum. A new type of beta-propeller architecture formed by oligomerization and interacting with fucoside, fucosyllactose, and plant xyloglucan";Kostlánová N, Mitchell EP, Lortat-Jacob H, Oscarson S, Lahmann M, Gilboa-Garber N, Chambat G, Wimmerová M, Imberty A;J Biol Chem. 2005 Jul 29;280(30):27839-49. Epub 2005 May 27
- ↑ Kaku H, Kaneko H, Minamihara N, Iwata K, Jordan ET, Rojo MA, Minami-Ishii N, Minami E, Hisajima S, Shibuya N.,Elderberry bark lectins evolved to recognize Neu5Ac alpha2,6Gal/GalNAc sequence from a Gal/GalNAc binding lectin through the substitution of amino-acid residues critical for the binding to sialic acid.J Biochem. 2007 Sep;142(3):393-401. Epub 2007 Jul 23.
- ↑ "A lectin from elder (Sambucus nigra L.) bark." Broekaert WF, Nsimba-Lubaki M, Peeters B, Peumans WJ, Biochem J. 1984 Jul 1;221(1):163-9.
- ↑ Ciopraga J, Angström J, Bergström J, Larsson T, Karlsson N, Motas C, Gozia O, Teneberg S., "Isolectins from Solanum tuberosum with different detailed carbohydrate binding specificities: unexpected recognition of lactosylceramide by N-acetyllactosamine-binding lectins."J Biochem. 2000 Nov;128(5):855-67.
Související články
- sacharidy
- proteiny
- glykoproteiny
- glykolipidy
- buněčná adheze
- nespecifická imunita
- afinitní chromatografie
Externí odkazy
 Obrázky, zvuky či videa k tématu lektiny na Wikimedia Commons
Obrázky, zvuky či videa k tématu lektiny na Wikimedia Commons
- Biological effects of plant lectins...
- World of Lectin links maintained by Thorkild C. Bøg-Hansen
- Proteopedia shows more than 800 three-dimensional molecular models of lectins, fragments of lectins and complexes with carbohydrates
- EY Laboratories, Inc World's largest lectin manufacturer.
- ekniha (Essentials of glycobiology)
Média použitá na této stránce
koplexní typ N-glykanu
manosový typ N-glykanuu
Hemagglutinin. Ribbon diagram of hemagglutinin molecule. Source: The National Center for Biotechology Information.
The National Center for Biotechology Information is a division of the National Library of Medicine, which is a division of the National Institutes of Health, which come under the jurisdiction of the US Department of Health and Human Services. Material made available by these institutions on line may be freely used as with all other US Federal government agencies.
The NCBI runs several biomedical databases of enormous importance to doctors and scientists around the world. One of them is MMDB, a bank of "experimentally determined three-dimensional biomolecular structures." These are freely available on their website in an open access fashion. The NCBI places no restrictions on their access and use, except to ask that appropriate crediting is observed. The structures database consists of 3d video imagery of important proteins and other structures that can be visualized with Cn3D software. The above image is a still that I captured from one of the dozens of free files of Hemagglutinin. In this sense, this image is derivative. I hereby declare that I claim no copyright whatsoever over this image, for my part. As far as the source of the image is concerned, this was as stated released freely by the NCBI with no restriction on its use. I am placing the NIH and HHS tags below (there is no NCBI tag on Wikipedia yet).vmezeřený GlcNAc v N-glykanu