Luminofor


Luminofor je látka, která vydává světlo, když je vystavena určitému typu zářivé energie. Tento jev nazýváme luminiscence a používá se jak pro fluorescenci nebo fosforescenci látek, které září, pokud jsou osvětleny ultrafialovým zářením nebo viditelným světlem, tak pro katodoluminiscenci látek, které září, když jsou vystaveny katodovému záření (proudu elektronů) v katodové trubici.
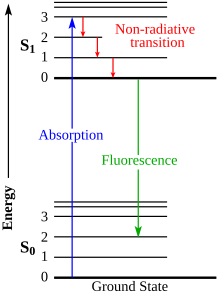
Je-li luminofor vystaven záření, elektrony v atomových obalech prvků, z nichž jsou složeny molekuly luminoforu jsou vybuzeny na vyšší energetickou hladinu a při návratu na původní hladinu emitují energii v podobě světla určité barvy. Luminofory lze rozdělit do dvou skupin: fluorescenční látky vydávají světlo pouze v době, kdy jsou vystaveny zdroji záření; a fosforescenční látky, které emitují záření se zpožděním, takže mohou zářit určitou dobu poté, co je zdroj záření vypnutý, takže jejich jas se snižuje po dobu několika milisekund až dní.
Fluorescenční materiály se používají v případech, kdy luminofor lze vybuzovat průběžně: ve výbojkách, zářivkách, bílých LED, vakuových a plazmových obrazovkách, při fluoroskopii, ve scintilačních senzorech, a pro světélkující nátěr a pro výtvarné umění používající černé světlo. Fosforeskující látky se používají, pokud je potřebné trvalé světlo, např. pro svítící ciferníky a letecké přístroje, a pro radarové obrazovky, kde je třeba, aby skvrny reprezentující zachycený cíl zůstaly viditelné při otáčení radaru. Luminofory pro vakuové obrazovky byly v období okolo druhé světové války standardizovány a označeny písmenem „P“ a číslem.
Chemický prvek fosfor, podle kterého je nazván jev fosforescence (a v angličtině i luminofor phosphor) však emituje světlo kvůli chemiluminiscenci, nikoli fosforescenci.[1]
Proces emise světla
Scintilace v anorganických materiálech je způsobena pásovou strukturou energetických hladin v krystalech. Přicházející částice může vybudit elektron z valenčního pásu buď do vodivostního pásu nebo pásu excitonu nacházejícího se těsně pod vodivostním pásem, od kterého je oddělen energetickou mezerou). Tím ve valenčním pásu vznikne elektronová díra. Příměsi vytvářejí elektronové úrovně v zakázaném pásu. Excitony jsou volně vázané páry elektron–díra, které putují krystalovou mřížkou, až jsou zachyceny jako celek atomem příměsi. Ten pak rychle přejde do základního stavu emisí fotonu (rychlá složka). V případě anorganických scintilátorů se příměs aktivátoru typicky volí tak, aby emitované světlo bylo ve viditelném nebo blízkém ultrafialovém oboru, kde jsou účinné fotonásobiče. Díry patřící k elektronům ve vodivostním páse jsou na nich nezávislé. Tyto díry a elektrony jsou postupně zachyceny centry příměsi vybuzeny do určitého metastabilního stavu, který není dostupný pro excitony. Opožděná de-excitace těchto metastabilních příměsových stavů zpomaluje závislostí na nízký-pravděpodobnost zakázaný mechanismus, opět vede k emisi světla (pomalá složka).
Luminofory jsou často sloučeniny přechodných kovů nebo vzácných zemin různých druhů. V anorganických luminoforech tyto nehomogenity v krystalové struktuře jsou obvykle vytvořeny přidáním stopového množství dopantů, příměsí zvaných aktivátory. (V řídkých případech mohou roli příměsi hrát dislokace nebo jiné poruchy krystalové mřížky.) Vlnová délka emitovaná emisním centrem závisí na centrálním atomu a na struktuře okolního krystalu.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Phosphor na anglické Wikipedii.
- ↑ Emsley, John, 2000. The Shocking History of Phosphorus. London: Macmillan. Dostupné online. ISBN 978-0-330-39005-7.
Literatura
- Arunachalam Lakshmanan, 2008. Luminescence and Display Phosphors: Phenomena and Applications. [s.l.]: Nova Publishers. Dostupné online. ISBN 978-1-60456-018-3.
Související články
Externí odkazy
- A history of electroluminescent displays Archivováno 30. 4. 2012 na Wayback Machine. – Historie elektroluminiscentních displejů.
- Fluorescence, Phosphorescence – Fosforescence.
- CRT Phosphor Characteristics (P numbers) – Označování luminoforů pro vakuové obrazovky P kódy.
- Composition of CRT phosphors – Složení luminoforů pro vakuové obrazovky.
- Silicon-based oxynitride and nitride phosphors for white LEDs—A review – Přehled oxynitridových a nitridových luminoforů na bázi křemíku pro bílé LED.
- [1] Archivováno 10. 4. 2023 na Wayback Machine. & [2] Archivováno 10. 4. 2023 na Wayback Machine. – RCA Manual, Fluorescent screens (P1 to P24) – Stránky z katalogů osciloskopických obrazovek firmy RCA.
- Inorganic Phosphors Compositions, Preparation and Optical Properties, William M. Yen and Marvin J. Weber Archivováno 6. 3. 2016 na Wayback Machine. – Anorganické luminofory – složení, příprava a optické vlastnosti.
Média použitá na této stránce
Autor: Д.Ильин: vectorization, Licence: CC0
Jablonski diagram of absorbance, non-radiative decay, and fluorescence.
Electronic transitions are about 1 eV. Vibrational transitions are about 0.1 eV. Rotational transitions (not shown) are about 0.001 eV. Absorption is about 1 femtosecond, relaxation takes about 1 picosecond, fluorescence takes about 1 nanosecond.
Autor: JJ Harrison (https://www.jjharrison.com.au/), Licence: CC BY-SA 3.0
Můžete si zvolit libovolnou z těchto licencí.




