Luminol

| Luminol | |
|---|---|
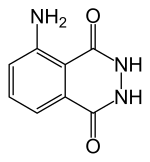 Chemická struktura luminolu | |
 3D model luminolu | |
| Obecné | |
| Systematický název | 5-amino-2,3-dihydroftalazin-1,4-dion |
| Ostatní názvy | 3-aminoftalhydrazid |
| Anglický název | Luminol |
| Německý název | Luminol |
| Sumární vzorec | C8H7N3O2 |
| Vzhled | Žlutá až bledě zelená nebo hnědá krystalická hmota |
| Identifikace | |
| Registrační číslo CAS | 521-31-3 |
| EC-no (EINECS/ELINCS/NLP) | 208-309-4 |
| PubChem | 10638 |
| Vlastnosti | |
| Molární hmotnost | 177,16 g/mol |
| Teplota varu | 319 °C, 592 K, 606 °F |
| Bezpečnost | |
| [1] Varování[1] | |
| R-věty | R36, R37, R38 |
| S-věty | S26, S27, S28, S29, S30, S33, S35, S36 |
Některá data mohou pocházet z datové položky. | |
Luminol (C8H7N3O2) je organická sloučenina, která má vlastnost chemické luminiscence, když je smíchána se správným oxidačním činidlem (např. peroxid vodíku), vydává při ní nápadné modré světlo. Jeho krystalky jsou rozpustné skoro ve všech polárních rozpouštědlech, ale nerozpustné ve vodě.
Luminol je používán vyšetřovateli ve forenzních vědách k vyhledávání krvavých stop na místě činu, kde luminol reaguje s kyslíkem. Ten vzniká rozkladem například peroxidu vodíku a tento rozklad je značně urychlen (katalyzován) železnatými ionty přítomnými v hemoglobinu. Také se používá k testům na přítomnost mědi, železa a kyanidu a při metodě Western blot, ve které slouží luminol jako substrát pro peroxidázu konjugovanou s použitou sekundární protilátkou.
Syntéza
Luminol může být syntetizován z 3-nitroftalové kyseliny. Nejdříve se hydrazin (N2H4) s 3-nitroftalovou kyselinou zahřívá v rozpouštědle s vysokým bodem varu, jako je triethylenglykol. Poté probíhá kondenzační reakce, při které se ztrácí voda a vzniká 3-nitroftalhydrazid. Dále se redukují nitro na aminoskupiny pomocí dithioničitanu sodného (Na2S2O4), kde produktem je luminol.
Luminol byl poprvé syntetizován v Německu roku 1902, ale nebyl pojmenován „luminol“ až do pozdních 20. let 20. století.[2]
Reference
V tomto článku byl použit překlad textu z článku Luminol na anglické Wikipedii.
- ↑ a b Luminol. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ NCATS Inxight: Drugs — LUMINOL. drugs.ncats.io [online]. [cit. 2021-04-16]. Dostupné online. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Luminol na Wikimedia Commons
Obrázky, zvuky či videa k tématu Luminol na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
diagram showing the chemical synthesis of luminol
Autor: David Muelheims (David Mülheims, Germany), Licence: CC BY-SA 2.5
Chemoluminescence with Luminol






