Makrocyklus

Makrocykly jsou molekuly obsahující cykly tvořené dvanácti nebo více atomy. Patří sem mimo jiné crown ethery, kalixareny, porfyriny, a cyklodextriny.[2]
Vznik
Reakce vytvářející makrocykly uzavíráním kruhů se nazývají makrocyklizace.[3]
První články zabývající se těmito sloučeninami byly zaměřené na terpenoidové makrocykly.[4]
Tvorba velkých cyklů je většinou nevýhodná, místo nich často vznikají malé kruhy nebo polymery. Tento nedostatek lze vyřešit zředěním reaktantů, které zvýhodní vnitromolekulární děje před polymerizací.[5]
Některé makrocyklizace se provádějí s využitím templátových reakcí. Jako templáty se používají ionty, molekuly, nebo povrchy, které vytvářejí předpřipravené sloučeniny, čímž usnadňují tvorbu kruhů o určitých velikostech.[6]
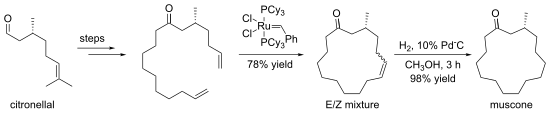
Crown ethery se často připravují za přítomnosti kationtů alkalických kovů, které se spojujícími se složkami vytváří komplexy.[7] Příkladem může být syntéza (−)-muskonu z (+)-citronellalu. 15členný kruh se vytváří metatezí s uzavíráním kruhu.[8]

Výskyt a využití
Důležitými makrocykly jsou makrocyklická antibiotika, nazývaná makrolidy, například klarithromycin. Makrocyklické ligandy, jako jsou porfyriny, koriny a chloriny, se navazují na ionty kovů, sloužící jako kofaktory.
Makrocykly na sebe často vážou ionty a usnadňují tak jejich transport přes hydrofobní membrány. Makrocyklus otevírá cestu přes hydrofobní vrstvu, a funguje tak jako katalyzátor fázového přenosu.[10]

Makrocykly jsou často biologicky aktivní a mohou být použity k doručování léčiv.[11][12]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Macrocycle na anglické Wikipedii.
- ↑ J. M. Hamilton-Miller. Chemistry and Biology of the Polyene Macrolide Antibiotics. Bacteriological Reviews. 1973. DOI 10.1128/br.37.2.166-196.1973. PMID 4578757.
- ↑ Zhichang Liu; Siva Krishna Mohan Nalluria; J. Fraser Stoddart. Surveying macrocyclic chemistry: from flexible crown ethers to rigid cyclophanes. Chemical Society Reviews. 2017. DOI 10.1039/c7cs00185a. PMID 28462968.
- ↑ Modern Supramolecular Chemistry: Strategies for Macrocycle Synthesis. Příprava vydání François Diederich, Peter J. Stang, Rik R. Tykwinski. [s.l.]: Wiley‐VCH, 2008. ISBN 9783527621484. DOI 10.1002/9783527621484.
- ↑ H. Höcker. Cyclic and Macrocyclic OrganicCompounds – a Personal Review in Honor of Professor Leopold Ružička. Cyclic and Macrocyclic Organic Compounds. 2009, s. 73–80. Dostupné online.
- ↑ Vicente Martí-Centelles; Mrituanjay D. Pandey; M. Isabel Burguete; Santiago V. Luis. Macrocyclization Reactions: The Importance of Conformational, Configurational, and Template-Induced Preorganization. Chemical Reviews. 2015, s. 8736–8834. DOI 10.1021/acs.chemrev.5b00056. PMID 26248133.
- ↑ Nicolai V. Gerbeleu; Vladimir B. Arion; John Burgess. Template Synthesis of Macrocyclic Compounds. [s.l.]: Wiley‐VCH, 2007. ISBN 9783527613809. DOI 10.1002/9783527613809.
- ↑ PEDERSEN, Charles J. Macrocyclic Polyethers: Dibenzo-18-Crown-6 Polyether and Dicyclohexyl-18-Crown-6 Polyether. Org. Synth.. 1988. Dostupné online.; Coll. Vol.. S. 395.
- ↑ V. P. Kamat; H. Hagiwara; T. Katsumi; T. Hoshi; T. Suzuki; M. Ando. Ring Closing Metathesis Directed Synthesis of (R)-(−)-Muscone from (+)-Citronellal. Tetrahedron. 2000, s. 4397–4403. DOI 10.1016/S0040-4020(00)00333-1.
- ↑ Paul R. Ortiz de Montellano. Wiley Encyclopedia of Chemical Biology. [s.l.]: John Wiley & Sons, 2008. ISBN 978-0470048672. DOI 10.1002/9780470048672.wecb221. Kapitola Hemes in Biology.
- ↑ Kihang Choi; Andrew D. Hamilton. Macrocyclic anion receptors based on directed hydrogen bonding interactions. Coordination Chemistry Reviews. 2003, s. 101–110. DOI 10.1016/s0010-8545(02)00305-3.
- ↑ Philipp Ermert. Design, Properties and Recent Application of Macrocycles in Medicinal Chemistry. Chimia International Journal for Chemistry. 2017-10-25, s. 678–702. DOI 10.2533/chimia.2017.678. PMID 29070413.
- ↑ Eric Marsault; Mark L. Peterson. Macrocycles Are Great Cycles: Applications, Opportunities, and Challenges of Synthetic Macrocycles in Drug Discovery. Journal of Medicinal Chemistry. 2011-04-14, s. 1961–2004. ISSN 0022-2623. DOI 10.1021/jm1012374. PMID 21381769.
Literatura
- Chambron, J-C.; DIETRICH-BUCHECKER, C.; HEMMERT, C.; KHEMISS, A-K.; MITCHELL, D.; SAUVAGE, J-P.; WEISS, J. Interlacing molecular threads on transition metals. Pure Appl. Chem.. 1990, s. 1027–34. Dostupné online. DOI 10.1351/pac199062061027.
- IYODA, Masahiko; YAMAKAWA, Jun; RAHMAN, M. Jalilur. Conjugated Macrocycles: Concepts and Applications. Angewandte Chemie International Edition. 2011-11-04, s. 10522–10553. ISSN 1521-3773. DOI 10.1002/anie.201006198. PMID 21960431.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Makrocyklus na Wikimedia Commons
Obrázky, zvuky či videa k tématu Makrocyklus na Wikimedia Commons
Média použitá na této stránce
Skeletal formula of uroporphyrinogen III. Created using ACD/ChemSketch 8.0 and Inkscape.
Erythromycin A
Ball-and-stick model of the 18-crown-6 potassium complex in crystalline (18-crown-6)potassium chlorochromate, [K(C12H24O6)][CrClO3].
X-ray diffraction data from S. A. Kotlyar, R. I. Zubatyuk, O. V. Shishkin, G. N. Chuprin, A. V. Kiriyak and G. L. Kamalov (February 2005). "(18-Crown-6)potassium chlorochromate". Acta. Cryst. E61 (2): m293-m295. DOI:10.1107/S1600536805000085.Autor: Hbf878, Licence: CC0
Formation of muscone from (R)-(+)-citronellal via ring-closing metathesis using a bis(tricyclohexylphosphine)benzylideneruthenium dichloride catalyst.
Redrawn from file:MusconeViaRCM.png. Original reference: Kamat, V.P.; Hagiwara, H.; Katsumi, T.; Hoshi, T.; Suzuki, T.; Ando, M. (2000). "Ring Closing Metathesis Directed Synthesis of (R)-(-)-Muscone from (+)-Citronellal". Tetrahedron 56 (26): 4397–4403. DOI:10.1016/S0040-4020(00)00333-1..