Malononitril
| Malononitril | |
|---|---|
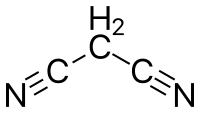 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | propandinitril |
| Funkční vzorec | NCCH2CN |
| Sumární vzorec | C3H2N2 |
| Vzhled | bílé krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 109-77-3 |
| EC-no (EINECS/ELINCS/NLP) | 203-703-2 |
| PubChem | 8010 |
| ChEBI | 33186 |
| SMILES | N#CCC#N |
| InChI | InChI=1S/C3H2N2/c4-2-1-3-5/h1H2 |
| Vlastnosti | |
| Molární hmotnost | 66,061 g/mol |
| Teplota tání | 32 °C (305 K)[1] |
| Teplota varu | 219 °C (492 K)[1] |
| Hustota | 1,191 g/cm3 (20 °C)[1] |
| Index lomu | 1,4146 g/cm3 (34 °C)[1] |
| Rozpustnost ve vodě | 13,3 g/100 ml[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v acetonu, ethanolu, kyselině octové a chloroformu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu[1] |
| Tlak páry | 27 Pa[1] |
| Ionizační energie | 12,88 eV[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H301 H311 H331 H400 H410[1] |
| P-věty | P261 P264 P270 P271 P273 P280 P301+316 P302+352 P304+340 P316 P321 P361+364 P391 P403+233 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Malononitril je organická sloučenina patřící mezi nitrily, se vzorcem CH2(CN)2. V čisté podobě jde o bílou pevnou látku, starší vzorky bývají zabarvené do žluta nebo hněda. Využití má v organické syntéze.
Příprava, výroba a reakce
Malononitril se dá připravit dehydratací kyanoacetamidu.[2] V průmyslu se nejčastěji používá reakce plynného acetonitrilu s chlorkyanem:[3]
- NCCl + CH3CN → NCCH2CN + HCl
Z malononitrilu se vyrábí thiamin, léčiva triamteren a minoxidil, a barviva disperzní žluť 90 a disperzní modř 354.[3]
Malononitril je slabě kyselý, jeho pKa má ve vodě hodnotu 11,4.[4] Lze jej tak zapojit do Knoevenagelových kondenzací, například při výrobě 2-chlorbenzylidenmalononitrilu:

Malononitril je také vhodný pro Gewaldovy reakce, kde kondenzují nitrily s ketony nebo aldehydy za přítomnosti zásady a elementární síry, přičemž se tvoří 2-aminované thiofeny.[5]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Malononitrile na anglické Wikipedii.
- ↑ a b c d e f g h i j k l m https://pubchem.ncbi.nlm.nih.gov/compound/8010
- ↑ Alexander Surrey. Malononitrile. Organic Syntheses. 1945, s. 63–64. doi:10.15227/orgsyn.025.0063.
- ↑ a b Harald Strittmatter; Stefan Hildbrand; Peter Pollak. Ullmann's Encyclopedia of Industrial Chemistry. [s.l.]: [s.n.], 2007. ISBN 978-3527306732. doi:10.1002/14356007.a16_063.pub2. Kapitola Malonic Acid and Derivatives.
- ↑ PUBCHEM. Malononitrile. pubchem.ncbi.nlm.nih.gov [online]. [cit. 2023-07-01]. Dostupné online. (anglicky)
- ↑ R. W. Sabnis; D. W. Rangnekar; N. D. Sonawane. 2-Aminothiophenes By The Gewald Reaction. Journal of Heterocyclic Chemistry. 1999, s. 333–345. Dostupné online. doi:10.1002/jhet.5570360203.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Malononitril na Wikimedia Commons
Obrázky, zvuky či videa k tématu Malononitril na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Synthesis of CS Gas
Autor: Jynto (talk), Licence: CC0
Ball-and-stick model of the malononitrile molecule, a compound with two nitrile groups. Also known as propanedinitrile.
Colour code:
- Carbon, C: black
- Hydrogen, H: white
- Nitrogen, N: blue
Strukturformel von Malosäuredinitril






