Manganistan amonný
| Manganistan amonný | |
|---|---|
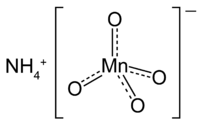 Tvar molekuly manganistanu amonného | |
| Obecné | |
| Systematický název | manganistan amonný |
| Anglický název | Ammonium permanganate |
| Sumární vzorec | NH4MnO4 |
| Vzhled | fialová krystalická látka, časem hnědne až černá; kosočtverečné krystaly |
| Identifikace | |
| Registrační číslo CAS | 13446-10-1 |
| Vlastnosti | |
| Molární hmotnost | 136,974 g/mol |
| Teplota rozkladu | 60 °C (může explodovat), 70 °C (exploduje) |
| Hustota | 2,21 g/cm3 |
| Rozpustnost ve vodě | 8 g/100 ml |
| Struktura | |
| Krystalová struktura | kosočtverečná |
| Bezpečnost | |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Manganistan amonný (chemický vzorec NH4MnO4, občas záměrně zapisováno jako NH3·HMnO4) je ve vodě rozpustná amonná sůl kyseliny manganisté a oxidační činidlo. Tato látka je velice výbušná, krystalický suchý manganistan amonný může explodovat při nárazu, tření krystalů, či při zahřívání nad 60 °C.
Reakce
Při explozi dochází k rozpadu na oxid manganičitý (MnO2), dusík (N2) a vodu (H2O), dle rovnice:
2 NH4MnO4 → 2 MnO2 + N2 + 4 H2O
Dusík, a částečně voda se podílejí na explozivních účincích
Výroba
Tato látka byla poprvé poprvé připravena roku 1824 reakcí manganistanu stříbrného (AgMnO4) a chloridu amonného (NH4Cl), za vzniku manganistanu amonného a chloridu stříbrného (AgCl), podle rovnice:
AgMnO4 + NH4Cl → NH4MnO4 + AgCl
Na rozdíl od jiných průmyslových výrob musí tato reakce probíhat mimořádně opatrně, a na oddělení produktů se nesmí používat teplo, proto se po nějakou dobu tato látka vyráběla první zmíněnou rovnicí. Sloučeniny stříbra jsou však drahé, proto se dnes využívají alternativy, zejména reakce manganistanu barnatého a síranu amonného za vzniku manganistanu amonného a síranu barnatého:
Ba(MnO4)2 + (NH4)2SO4 → 2 NH4MnO4 + BaSO4
Další možností je reakce manganistanu hlinitého (Al(MnO4)3) s uhličitanem amonný ((NH4)2CO3) za vzniku vody (H2O), hydroxidu hlinitého (Al(OH)3), oxidu uhličitého (CO2) a manganistanu amonného.
2 Al(MnO4)3 + 3 (NH4)2CO3 + 3 H2O → 2 Al(OH)3 + 3 CO2 + 6 NH4MnO4
Manganistan hlinitý je možno vyrobit reakcí manganistanu draselného se síranem hlinitým, za vzniku manganistanu hlinitého, avšak je kontaminován síranem draselno-hlinitým (KAl(SO4)2·12H2O)
6 KMnO4 + 4 Al2(SO4)3·18 H2O → 2 Al(MnO4)3 + 6 KAl(SO4)2·12H2O + 6 H2O
Tak či tak, produkty se od sebe oddělí filtrací, jelikož chlorid stříbrný, síran barnatý a hydroxid hlinitý jsou nerozpustné ve vodě.
Skladování
Při skladování této látky za normální teploty dochází k jejímu rozpadu. Po době delší než půl roku vzorky začínají zapáchat jako oxidy dusíku. Při skladování ve vodě oxidy dusíku urychlují rozpad, ale na skladování na krátkou dobu to nevadí, podobně jako u mnoha dalších látek dochází ke snížení rizika exploze.
Média použitá na této stránce
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Chemical diagram of Ammonium permanganate
The hazard symbol for explosive substances according to directive 67/548/EWG by the European Chemicals Bureau.






