Manganistan vápenatý
| Manganistan vápenatý | |
|---|---|
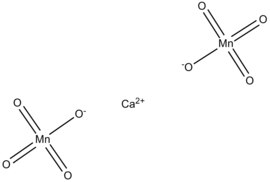 Vzorec | |
| Obecné | |
| Systematický název | Manganistan vápenatý |
| Sumární vzorec | CaMn2O8 |
| Vzhled | Fialová krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 10118-76-0 |
| Vlastnosti | |
| Molární hmotnost | 277,949 9 g/mol (bezvodý); 350,011 2 g/mol (tetrahydrát) |
| Teplota rozkladu | 140 °C; tj. 413 K |
| Hustota | 2,49 g/cm³ (bezvodý) |
| Rozpustnost ve vodě | Pro tetrahydrát: 331 g/100 g (H2O) (14 °C) 338 g/100 g (H2O) (25 °C) |
| Rozpustnost v polárních rozpouštědlech | Rozpustný v kapalném amoniaku; reaguje s ketony, aldehydy a alkoholy |
| Struktura | |
| Krystalová struktura | Kosočtverečná |
| Bezpečnost | |
| R-věty | R8, R22, R50/53 |
| S-věty | S2, S60, S61 |
| NFPA 704 | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Manganistan vápenatý je fialová, anorganická sloučenina se vzorcem Ca(MnO4)2. Tato látka sama o sobě je poměrně stabilní, v kombinaci s organickými materiály či silnými kyselinami se však stává nebezpečnou.
Výroba
Tuto látku je možno v laboratorních podmínkách vyrábět reakcí manganistanu draselného a chloridu vápenatého, vzniká manganistan vápenatý, ale vzniká i chlorid draselný, který je ve vodě docela dobře rozpustný, proto je to těžko odstranitelná kontaminace.Rovnice probíhá následně:
2KMnO4 + CaCl2 → Ca(MnO4)2 + 2KCl
Oddělení těchto látek se provádí při snížené teplotě, kolem 0 °C, kdy je rozpustnost chloridu draselného nejnižší, cca 28 g/100 g (H2O).
Další možností výroby jest reakce manganistanu hlinitého a oxidu vápenatého. Při reakci vzniká jako vedlejší produkt oxid hlinitý a malé množství hydroxidu hlinitého, které jsou nerozpustné, a dají se tedy jednoduše oddělit od manganistanu vápenatého. Reakce probíhá za zvýšené teploty, a bez přítomnosti vody. Probíhá dle rovnice:
2 Al(MnO4)3 + 3 CaO → 3 Ca(MnO4)2 + 2 Al2O3
Nakonec se produkty oddělují rozpuštěním ve vodě a filtrací.
Reakce
Tato látka se při zahřívání na cca 140 °C rozpadá na oxid manganičitý, oxid vápenatý a kyslík, dle rovnice:
2Ca(MnO4)2 —t→ 2 CaO + 4 MnO2 + 3 O2
Proto je tato látka oxidačním činidlem (podstatně slabším, než kupříkladu manganistan draselný). Při kontaktu s organickými materiály (alkoholy, ketony, aldehydy, sulfid uhličitý, benzen, benzín, estery a ethery) se může vznítit, popřípadě explodovat, někdy je potřeba mírné zahřátí.
Reaguje s kyselinou sírovou za vzniku kyseliny manganisté, a následně oxidu manganistého, který je rovněž explozivní:
Ca(MnO4)2 + H2SO4 → CaSO4 + 2HMnO4 → CaSO4 + Mn2O7 + H2O
Nereaguje tak se všemi, kyselinami kupříkladu s kyselinou chlorovodíkovou uvolňuje plynný chlór:
Ca(MnO4)2 + 22HCl → CaCl2 + 8Cl2 + 2MnCl2 + 8H2O + 3H2
Využití
Tato látka se experimentálně používá na bělení zubů, dále tato látka má dezinfekční účinky, nepoužívá se však příliš často.
Bezpečnost
Při kontaktu roztoku látky s kůží vzniká na místě hnědo-černá skvrna, která po čase zmizí. Zmizení této skvrny se dá urychlit kupříkladu použitím kyseliny octové, stejně tak se dá vzniká skvrna odstranit z oblečení. V případě kontaktu této látky s očima často dochází k poškození zraku, či až oslepnutí.
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.








