Methan
| Methan | |
|---|---|
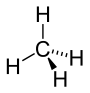 Strukturní vzorec | |
 Tyčinkový model | |
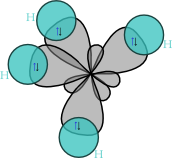
 Kalotový model | |
| Obecné | |
| Systematický název | methan |
| Triviální název | bahenní plyn |
| Ostatní názvy | metan |
| Sumární vzorec | CH4 |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 74-82-8 |
| EC-no (EINECS/ELINCS/NLP) | 200-812-7 |
| Indexové číslo | 601-001-00-4 |
| Vlastnosti | |
| Molární hmotnost | 16,042 6 g/mol |
| Teplota tání | −182,5 °C |
| Teplota varu | −161,6 °C |
| Hustota | 0,676 kg/m3 (plyn, 21 °C, 1 013 hPa) 0,422 62 g/cm3 (kapalina, −161,6 °C, 1 013 hPa) |
| Kritická teplota Tk | −82,7 °C |
| Kritický tlak pk | 4,596 MPa |
| Rozpustnost ve vodě | 0,22 mg/l (20 °C) |
| Struktura | |
| Dipólový moment | 0 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H220 |
| R-věty | R12 |
| S-věty | (S2) S9 S16 S33 |
| NFPA 704 | |
| Teplota vzplanutí | −188 °C |
| Teplota vznícení | 600 °C |
| Meze výbušnosti | 5–15 % |
Některá data mohou pocházet z datové položky. | |

Methan (mimo chemii dle PČP metan) neboli podle systematického názvosloví karban je nejjednodušší alkan, a tedy i nejjednodušší stabilní uhlovodík vůbec. Při pokojové teplotě je to netoxický plyn bez barvy a zápachu, lehčí než vzduch (relativní hustota 0,55 při 20 °C).
Příprava
Hlavním zdrojem methanu je přírodní surovina zemní plyn. Přímá příprava sloučením uhlíku s vodíkem je prakticky nemožná, vzhledem k tomu, že by uhlík musel být nejprve převeden do plynného stavu. Teoreticky však lze methan připravit dvoustupňovou syntézou přes sirouhlík
- C + 2 S → CS2,
který pak reakcí se sulfanem (sirovodíkem) a mědí dá methan
- CS2 + 2 H2S + 8 Cu → CH4 + 4 Cu2S.
Jinou možností je reakce karbidu hliníku s vodou
- Al4C3 + 12 H2O → 3 CH4 + 4 Al(OH)3.
Laboratorně se dá připravit žíháním směsi octanu sodného s hydroxidem sodným (natronovým vápnem)
- CH3COONa + NaOH → CH4 + Na2CO3.
Vlastnosti
Molekula methanu má symetrii pravidelného čtyřstěnu (bodová grupa symetrie Td), v jehož těžišti se nachází uhlíkový atom a v jehož vrcholech se nacházejí vodíkové atomy. Díky této vysoké symetrii je celkově molekula methanu nepolární, přestože vazby H–C slabou polaritu vykazují.
Methan může reagovat explozivně s kyslíkem
CH4 + 2 O2 → CO2 + 2 H2O.
Bod samozážehu je sice velmi vysoký (595 °C, teplota vznícení při koncentraci 8,5 % je 537 °C), ale stačí např. elektrická jiskra nebo otevřený plamen a směs methanu se vzduchem může být přivedena k výbuchu (minimální iniciační energie je 0,28 mJ). Přitom meze výbušnosti jsou značně velké, od 4,4 do 15 objemových procent. Proto je nezbytně nutné průběžně sledovat koncentraci methanu (důlního plynu) v uhelných dolech, aby se předešlo katastrofám. Podobně prudce může methan reagovat i s plynným chlorem, je-li reakce iniciována prudkým zahřátím. Za normální teploty probíhá pomalu čtyřstupňově za vzniku chlorovaných derivátů methanu
- CH4 + Cl2 → CH3Cl + HCl,
- CH3Cl + Cl2 → CH2Cl2 + HCl,
- CH2Cl2 + Cl2 → CHCl3 + HCl,
- CHCl3 + Cl2 → CCl4 + HCl.
Podobně reaguje i s jinými halogeny. Jinak je málo reaktivní.
- Dokonalé hoření methanu
- CH4 + 2O2 → CO2 + 2H2O
- Nedokonalé hoření methanu
- CH4 + O2 → 2H2O + C, nebo
- 2CH4 + 3O2 → 4H2O + 2CO
Výskyt v přírodě
Methan se přirozeně vyskytuje na Zemi:
- v atmosféře, kam se dostává zejména jako produkt rozkladu látek biogenního původu (bioplyn), nebo jako produkt metabolismu velkých přežvýkavců, také z termitišť a z rýžových polí.
- v podzemí:
- jako hlavní složka zemního plynu
- jako součást důlního plynu v dolech
- rozpuštěný v ropě
- rozpuštěný ve vodě některých jezer, zvláště v Africe (např. jezero Kivu mezi Rwandou a Kongem)
- tvoří bublinky pod ledem rozmrzajícího permafrostu, například na Sibiři

Přítomnost ve vesmíru
Ve vesmíru byl nalezen v plynných mračnech v mezihvězdném prostoru.
Dále je obsažen v atmosférách velkých planet (Jupiter, Saturn, Uran a Neptun) sluneční soustavy. V pevném stavu je součástí tzv. ledových měsíců velkých planet a tvoří zřejmě nezanedbatelnou část hmoty transneptunických těles, případně je vysrážen ve formě ledu nebo jinovatky na jejich povrchu (např. Pluto). Byl také prokázán v komách komet.
Původ na Zemi
Na Zemi pochází asi 90 % metanu z produkce živých organismů, menší část vzniká při geologických aktivitách (např. tavením magmatu). Mezi přírodní zdroje patří mokřady (hnilobné procesy), lesy, mořské ekosystémy a také mikroorganismy v trávicím ústrojí živočichů (například archea v trávicím traktu skotu). Dalším zdrojem je těžba a spalování fosilních paliv, zemědělství (chov skotu) a skládky.[2]
Podle studie z Institutu pro arktický a alpinský výzkum z roku 2024 jsou za růst koncentrace metanu v atmosféře Země v posledních letech[kdy?] zodpovědné mikroorganismy a nikoliv fosilní paliva. Původně bylo odhadováno, že fosilní zdroje mohou až za 30 % produkce, což studie zpochybňuje na základě obsahu izotopu uhlíku 13C. Zda je zvýšení produkce metanu z mikrobiálních zdrojů přírodního původu nebo důsledek lidské činnost, zatím není jasné.[2]
Ve vesmíru však bez dalších podkladů nelze původ metanu prokázat.[3] Zprávy některých médií, které z objevu metanu usuzují na existenci života ve vesmíru, jsou proto považovány za nepodložené.[4]
Použití

Hlavní oblastí použití methanu je energetika, kde slouží ve směsi s jinými uhlovodíky jako plynné palivo. V automobilové dopravě představuje jednu z pohonných látek, pod označením CNG (Compressed Natural Gas), stlačený zemní plyn, jehož hlavní složku tvoří právě methan.
Methan je spolu s kyslíkem používán jako palivo pro raketové motory vesmírné lodi Starship.[5]
V chemickém průmyslu se používá především k výrobě oxidu uhličitého dokonalým spalováním se vzduchem a při nedokonalém spalování k výrobě sazí používaných jako plnidlo a barvivo v gumárenském průmyslu. Pyrolýzou (tepelným rozkladem) za nepřístupu vzduchu se vyrábí ethyn (acetylen) a vodík.
Ekologické účinky



Vzhledem k tomu, že methan silně absorbuje infračervené záření, patří mezi významné skleníkové plyny zvyšující teplotu zemské atmosféry (je přibližně 20krát účinnější než oxid uhličitý, ale jeho obsah v atmosféře je oproti tomu asi 200krát menší než u oxidu uhličitého: 0,0002 % methanu a 0,04 % oxidu uhličitého, takže jeho vliv je přibližně 10krát menší).[pozn. 1] Metan se v atmosféře rozpadá během 10 až 12 let, takže jeho působení je sice intenzivnější než CO2, ale krátkodobější.[2]
Produkují ho (prostřednictvím mikrobů)[6] hlavně mokřady, dále hospodářská zvířata a v menší míře průmysl a skládky.[7] Významným producentem jsou ale i jezera[8] a fjordy.[9] Byly objeveny i další zdroje: mořští mlži,[10][11] či některé ledovce.[12] Produkují ho i stromy.[13] Zhruba polovina emisí methanu je z vodních ekosystémů.[14] Studie dříve uvažovaly, že vlivem globálního oteplování se bude methan uvolňovat i z oceánu[15] či tundry; nejnovější výzkumy však ukazují, že tomu tak být nemusí.[16] Uvolňování metanu se také nadhodnocovalo.[17]
Methan je v atmosféře oxidován především působením hydroxylových radikálů. Dosavadní scénáře budoucího vývoje klimatu vycházejí z představy, že spolu s nárůstem koncentrace metanu bude v množství hydroxylových radikálů v atmosféře ubývat. Dlouhodobé sledování troposféry podalo důkaz, že koncentrace radikálu OH neklesají.[18] Jeho molekuly opětovně vznikají působením slunečního záření. Jedním zdrojem jsou oxidy dusíku, druhým pak vodní pára a ozon za přispění ultrafialového záření v nižších vrstvách atmosféry.
Odkazy
Poznámky
- ↑ Pro přehled účinnosti skleníkových plynů viz tabulka v hesle skleníkové plyny
Reference
- ↑ a b Methane. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ a b c MIHULKA, Stanislav. Za rostoucí emise metanu jsou podle vědců zodpovědné hlavně mikroorganismy. StoPlusJednicka.cz [online]. 2024-11-12 [cit. 2024-11-13]. Dostupné online.
- ↑ BRANDEJSKÁ, Anna. Vědci znovu objevili metan na Marsu, mohl by znamenat život [online]. iDnes, 2009-01-15 [cit. 2009-01-18]. Dostupné online.
- ↑ KUBALA, Petr. Metan na Marsu není téma pro bulvár [online]. Česká astronomická společnost, 200-01-16 [cit. 2009-01-18]. Dostupné online.
- ↑ MELECHIN, Petr. Vše o Starship [online]. 2019-01-26 [cit. 2022-01-10]. Dostupné online.
- ↑ Mikrobi způsobili v posledních letech vyšší emise metanu než fosilní paliva. ct24.ceskatelevize.cz [online]. [cit. 2024-10-22]. Dostupné online.
- ↑ PAZDERA, Josef. Dobytek otepluje Zemi více, než ropný těžařský průmysl s plynárenským dohromady. osel.cz [online]. 2014-07-15 [cit. 2023-01-13]. Dostupné online.
- ↑ PURCHASE, Delyth. Study shows lake methane emissions should prompt rethink on climate change. phys.org [online]. 2019-12-04 [cit. 2023-01-13]. Dostupné online. (anglicky)
- ↑ University of Gothenburg. Fjords may emit as much methane as all the deep oceans globally. phys.org [online]. 2022-05-27 [cit. 2023-01-13]. Dostupné online. (anglicky)
- ↑ Baltic Sea clams 'giving off as much gas as 20,000 cows'. BBC News [online]. 2017-10-13 [cit. 2023-01-13]. Dostupné online. (anglicky)
- ↑ NASCIMENTO, Francisco J. A.; FRU, Ernest Chi; ALESSANDRA VICENZI. Methane fluxes from coastal sediments are enhanced by macrofauna. Scientific Reports. 2017-10-13, roč. 7, čís. 1, s. 1–10. Dostupné online [cit. 2019-08-12]. ISSN 2045-2322. doi:10.1038/s41598-017-13263-w. PMID 29030563. (anglicky)
- ↑ PAZDERA, Josef. Oteplují ledovce planetu? Některé ano!. osel.cz [online]. 2018-11-27 [cit. 2023-01-13]. Dostupné online.
- ↑ JEFFREY, Luke. Methane-eating bacteria found in a common tree is possible game-changer for curbing greenhouse gases. sciencex.com [online]. [cit. 2023-01-13]. Roč. 2021-04-09. Dostupné online. (anglicky)
- ↑ ROSENTRETER, Judith. Half of global methane emissions come from aquatic ecosystems—much of it human-made. sciencex.com [online]. 2021-04-06 [cit. 2023-01-13]. Dostupné online. (abgkucjy)
- ↑ Study finds hydrate gun hypothesis unlikely. phys.org [online]. 2017-08-23 [cit. 2023-01-13]. Dostupné online. (anglicky)
- ↑ Oregon State University. Methane from tundra, ocean floor didn't spike during previous natural warming period. phys.org [online]. 2017-08-23 [cit. 2023-01-13]. Dostupné online. (anglicky)
- ↑ Center for Arctic Gas Hydrate, Climate and Environment. Climate gas budgets highly overestimate methane discharge from Arctic Ocean. phys.org [online]. 2020-01-13 [cit. 2023-01-13]. Dostupné online. (anglicky)
- ↑ PAZDERA, Josef. Čistič skleníkových plynů se recykluje. osel.cz [online]. 2018-12-03 [cit. 2023-01-13]. Dostupné online. (anglicky)
Literatura
- Ibler Z. a kol.: Energetika technický průvodce, 2002 BEN - technická literatura, ISBN 80-7300-026-1
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu methan na Wikimedia Commons
Obrázky, zvuky či videa k tématu methan na Wikimedia Commons  Slovníkové heslo metan ve Wikislovníku
Slovníkové heslo metan ve Wikislovníku Encyklopedické heslo Methan v Ottově slovníku naučném ve Wikizdrojích
Encyklopedické heslo Methan v Ottově slovníku naučném ve Wikizdrojích- Methane, CH4, Physical properties, safety
- Umweltlexikon Archivováno 16. 3. 2005 na Wayback Machine.
- Metanová časovaná bomba (o ekologických účincích metanu)
Média použitá na této stránce
Autor: by Sinuhe, Licence: CC BY-SA 3.0
My feeble attempt at drawing methane in terms of hybrid orbitals
Autor: DeWikiMan, Licence: CC BY-SA 4.0
Atmospheric methane concentrations in the Common Era (yrs. 0–2016).
- Blue line:
- Name of dataset: Law Dome Ice Core 2000-Year CH4 Data
- last update: 7/2010 (Original receipt by WDC Paleo)
- contributor: David Etheridge, CSIRO Marine and Atmospheric Research
- IGBP PAGES/WDCA contribution series number: 2010-070
- Online: ncdc.noaa.gov, accessed 2017-03-18
- cf: C. MacFarling Meure et al.: Law Dome CO2, CH4 and N2O ice core records extended to 2000 years BP. In: Geophysical Research Letters. Volume 33, L14810, doi:10.1029/2006GL026152, 2006
- Red line:
- Cape Grim data: "CSIRO Marine and Atmospheric Research and the Australian Bureau of Meteorology (Cape Grim Baseline Air Pollution Station)" (CSIRO and the Australian Bureau of Meteorology give no warranty regarding the accuracy, completeness, currency or suitability for any particular purpose and accept no liability in respect of data.)
- Online: csiro.au, accessed 2017-03-18
Chemical structure of methane.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Danae Y Macarena a:D
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.













