Methyl-acetát
| Methyl-acetát | |
|---|---|
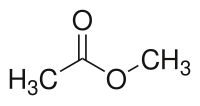 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | methyl-acetát |
| Funkční vzorec | CH3COOCH3 |
| Sumární vzorec | C3H6O2 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 79-20-9 |
| EC-no (EINECS/ELINCS/NLP) | 201-185-2 |
| PubChem | 6584 |
| ChEBI | 77700 |
| SMILES | O=C(OC)C |
| InChI | 1S/C3H6O2/c1-3(4)5-2/h1-2H3 |
| Vlastnosti | |
| Molární hmotnost | 74,079 g/mol |
| Teplota tání | −98,2 °C (175,0 K)[1] |
| Teplota varu | 56,7 °C (329,8 K)[1] |
| Hustota | 0,9342 g/cm3 (20 °C)[1] |
| Rozpustnost ve vodě | 24,3 g/100 ml (20 °C)[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethanolu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v diethyletheru[1] |
| Tlak páry | 23,1 kPa (20 °C) 28,8 kPa (20 °C)[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H225 H319 H336[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P261 P264+265 P271 P280 P303+361+353 P304+340 P305+351+338 P319 P337+317 P370+378 P403+233 P403+235 P405 P501[1] |
| Teplota vzplanutí | −10 °C (263 K)[1] |
Některá data mohou pocházet z datové položky. | |
Methyl-acetát je organická sloučenina patřící mezi estery kyseliny octové, se vzorcem CH3COOCH3 (zkráceně AcOMe či MeOAc). Používá se ojediněle jako rozpouštědlo, lipofilní a slabě polární, častěji je ale používán podobný ethyl-acetát, který je méně toxický a méně se rozpouští ve vodě; methyl-acetát může za pokojové teploty vytvořit až 25% vodný roztok a za vyšších teplot se rozpouští ještě lépe. Ve vodných roztocích silných zásad a kyselin se rozkládá.
Výroba
Methyl-acetát se získává jako vedlejší produkt karbonylace methanolu při výrobě kyseliny octové.[2] Vytvořit se může také esterifikací kyseliny octové methanolem za přítomnosti silných kyselin, například sírové; účinnost tohoto postupu lze zlepšit pomocí reaktivní destilace.
Reakce
Za přítomnosti silných zásad, například hydroxidu sodného, nebo silných kyselin, jako je kyselina chlorovodíková nebo sírová, se methylacetát hydrolyzuje na methanol a kyselinu octovou; tento rozklad se urychluje s rostoucí teplotou. Reakce s kyselinou je vzhledem k esteru prvního řádu a reakce se zásadou je vůči oběma reaktantům druhého řádu.
Methylacetát funguje jako Lewisova zásada, která vytváří 1:1 adukty s Lewisovými kyselinami. Patří mezi tvrdé zásady.
Použití
Methylacetát se používá jako těkavé rozpouštědlo v lepidlech, barvách a odlakovačích na nehty.
Acetanhydrid se vyrábí karbonylací methylacetátu.[3]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Methyl acetate na anglické Wikipedii.
- ↑ a b c d e f g h i j k l https://pubchem.ncbi.nlm.nih.gov/compound/6584
- ↑ Hosea Cheung, Robin S. Tanke, G. Paul Torrence Acetic Acid, Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim DOI:10.1002/14356007.a01_045
- ↑ J. R. Zoeller; V. H. Agreda; S. L. Cook; N. L. Lafferty; S. W. Polichnowski; D. M. Pond. Eastman Chemical Company Acetic Anhydride Process. Catalysis Today. 1992, s. 73–91. DOI 10.1016/0920-5861(92)80188-S.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Methyl-acetát na Wikimedia Commons
Obrázky, zvuky či videa k tématu Methyl-acetát na Wikimedia Commons
Média použitá na této stránce
Structual formula of methyl acetate.
CAS® Registry Number: 79-20-9
Image generated in ChemDraw Professional 22.2 and converted into SVG file using Scribus 1.5.4 + Inkscape 1.2.1 (drawn according to official Manual of Style guidelines)Autor: Jynto (talk), Licence: CC0
Ball-and-stick model of the methyl acetate molecule, also known as methyl ethanoate, the ester of methanol and acetic acid.
Colour code:
- Carbon, C: black
- Hydrogen, H: white
- Oxygen, O: red
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances





