Methylisokyanát
| Methylisokyanát | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | methylisokyanát |
| Ostatní názvy | MIC |
| Anglický název | methyl isocyanate, isocyanatomethane, methyl carbylamine |
| Sumární vzorec | C2H3NO |
| Vzhled | bezbarvý |
| Identifikace | |
| Registrační číslo CAS | 624-83-9 |
| ChEBI | 59059 |
| SMILES | O=C=NC |
| InChI | 1S/C2H3NO/c1-3-2-4/h1H3 |
| Vlastnosti | |
| Molární hmotnost | 57,051 g/mol |
| Teplota tání | −45 °C |
| Teplota varu | 39.5 °C |
| Hustota | 0.9230 g/cm3 při 27 °C |
| Struktura | |
| Dipólový moment | 2.8 D |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H314 H330 H351 H332 H302 H400 |
| R-věty | R20/22 R26 R34 R40 R50 |
| S-věty | S9, S26, S36/37/39, S45 |
| NFPA 704 | |
| Teplota vzplanutí | −7 °C |
| Teplota vznícení | 534 °C |
| Meze výbušnosti | 5,3–26 % |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Methylisokyanát je vysoce toxická organická sloučenina CH3NCO nazývaná také methylkarbylamin nebo MIC. Je meziproduktem při výrobě pesticidů a insekticidů jako např. karbaryl.
Výroba
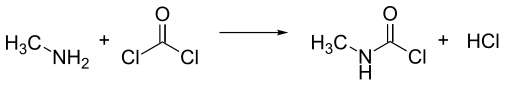
Vyrábí se reakcí methylaminu a fosgenu za vysoké teploty v plynné fázi. Vzniká směs methyl isokyanátu a dvou molů chlorovodíku, který reaguje na N (MCC), který ze směsi kondenzuje. Jeden mol chlorovodíku odchází jako plyn.
Methyl isokyanát se získá úpravou MCC pomocí reakce s terciárním aminem, jako je např. N,N-dimethylanilin,[2] nebo s pyridinem, nebo se oddělí destilací.
Také vzniká reakcí N-methylformamidu C2H5NO a vzduchu meziprodukt methomyl C5H10N2O2S při výrobě karbofuranu.[3]
Zdraví
MIC je prudce jedovatý, dráždivý. Při vdechování, požití a expozici sliznic se objevuje podráždění již při nízkém množství (0,4 ppm). Mezi příznaky otravy patří kašel, bolest na hrudi, dušnost, astma, podráždění očí, nosu a krku, svědění a pálení kůže. Vyšší úroveň expozice, (nad 21 ppm) má za následek trvalé (částečné) poškození zraku, plicní edém, rozedmu plic a krvácení, bronchiální pneumonii až s následkem smrti.
Ačkoli je methylisokyanát bez zápachu, většina lidí jeho přítomnost rozpozná především kvůli vysoce slzotvornému účinku již od 0,2 ppm. Limitní (bezpečné) hodnoty stanovené americkou konferencí veřejných a průmyslových hygieniků jsou 0,02 ppm.[4] Methylisokyanát je sloučenina zodpovědná za otravu a smrt několika tisíců lidí v indickém Bhópálu.[5]
Odkazy
Reference
- ↑ a b Methyl isocyanate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ US patent 2480088
- ↑ A safer method for making carbamates. Chemical Week. 1985, s. 136. (anglicky)
- ↑ Kimmerle, G.; Eben, A. Zur Toxizität von Methylisocyanat und dessen quantitativer Bestimmung in der Luft. Archiv für Toxikologie. 1964, s. 235–241. (anglicky)
- ↑ Union Carbide Corporation "Methyl Isocyanate" Product Information Publication, F-41443, November 1967.
Externí odkazy
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Autor: Hbf878, Licence: CC0
Formation of methyl isocyanate (MIC) and hydrochloric acid from N-methylcarbamoyl chloride (MCC).
Chemical structure of methyl isocyanate
Reaction of Monomethylamine (MMA) and phosgene to form N-methylcarbamoyl chloride (MCC) and hydrochloric acid.