Methyllithium
| Methyllithium | |
|---|---|
 Model struktury | |
| Obecné | |
| Systematický název | methyllithium |
| Ostatní názvy | methanid lithný |
| Sumární vzorec | CH3Li |
| Identifikace | |
| Registrační číslo CAS | 917-54-4 |
| EC-no (EINECS/ELINCS/NLP) | 213-026-4 |
| PubChem | 2724049 |
| ChEBI | 51486 |
| SMILES | [Li]C |
| InChI | 1S/CH3.Li/h1H3; |
| Vlastnosti | |
| Molární hmotnost | 21,976 g/mol |
| Bezpečnost | |
| [1] | |
| H-věty | H224 H250 H252 H260 H302 H314 H336 H412[1] |
| P-věty | P210 P222 P223 P231+232 P233 P235+410 P240 P241 P242 P243 P260 P261 P264 P270 P271 P273 P280 P301+312 P301+330+331 P302+334 P303+361+353 P304+340 P305+351+338 P310 P312 P321 P330 P335+334 P363 P370+378 P402+404 P403+233 P403+235 P405 P407 P413 P420 P422 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Methyllithium je organická sloučenina se vzorcem CH3Li (zkráceně MeLi), nejjednodušší organolithná sloučenina. Tato značně reaktivní látka, zaujímající v pevném stavu i v roztocích oligomerní strukturu, se v podobě etherového roztoku používá v organické syntéze a organokovové chemii. Pracuje se s ním se v bezvodých prostředích, protože s vodou prudce reaguje; také je citlivé na kyslík a oxid uhličitý. Obvykle se nepřipravuje, protože je dostupné rozpuštěné v různých etherech.
Výroba a příprava
Při přímé syntéze reaguje brommethan se suspenzí lithia v diethyletheru.
- 2 Li + MeBr → LiMe + LiBr
Vzniklý bromid lithný vytváří s methyllithiem komplex, ten je tak obsažen ve většině komerčně dostupného methyllithia. Methyllithium bez halogenidů se získává z chlormethanu.[2] Chlorid lithný se z diethyletheru vysráží, protože s methyllithiem netvoří stálejší komplex; filtrát tak obsahuje methyllithium v dobré čistotě.
Komerčně dostupné methyllithium může být také zreagováno s 1,4-dioxanem, přičemž se vysráží LiBr(dioxan), jenž se poté oddělí filtrací.[3]
Reakce
Methyllithium je jak silně zásadité. tak i velmi nukleofilní (v důsledku částečného záporného náboje na atomu uhlíku) a snadno tak reaguje s akceptory elektronů a donory protonů. Oproti n-BuLi MeLi s tetrahydrofuranem za pokojové teploty reaguje pomalu a etherové roztoky jsou neomezeně stálé. Reakce s vodou a alkoholy jsou velmi prudké a nebezpečné; obecně se reakce, do kterých je zapojeno methyllithium, provádějí za nízkých teplot. MeLi lze použít k deprotonacím, častěji se ovšem k tomuto účelu používá n-butyllithium, protože je méně nákladné a reaktivnější.
Methyllithium se nejobvykleji používá jako ekvivalent methylového aniontu, například s ketony vytváří dvoukrokově terciární alkoholy:
- Ph2CO + MeLi → Ph2C(Me)OLi
- Ph2C(Me)OLi + H+ → Ph2C(Me)OH + Li+
Halogenidy nekovů se přeměňují na odpovídající methylové sloučeniny:
- PCl3 + 3 MeL → PMe3 + 3 LiCl
K takovýmto reakcím častěji slouží methylmagnesiumhalogenidy, jež jsou podobně účinné a méně nákladné, případně snadněji připravitelné.
Methyllithium také reaguje s oxidem uhličitým za vzniku octanu lithného:
- CH3Li + CO2 → CH3CO2−Li+
Reakcemi s halogenidy kovů se tvoří methylové sloučeniny, například skupina organických sloučenin mědi nazývaných Gilmanova činidla, kam mimo jiné patří dimethylměďnan lithný. Tato činidla se používají na nukleofilní substituce epoxidů, halogenalkanů a alkylsulfonátů, také na konjugované adice methylových aniontů na α,β-nenasycené karbonylové sloučeniny.[4]
Obdobně byla připravena řada dalších methylových sloučenin.[5]
- ZrCl4 + 6 MeLi → Li2ZrMe6 + 4 LiCl
Struktura
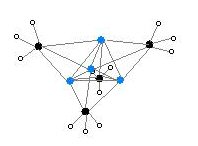
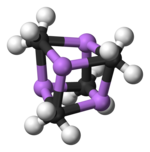
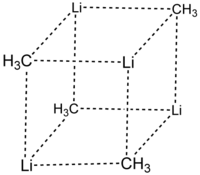
Rentgenovou krystalografií a (6Li, 7Li a 13C) NMR spektroskopií byly nalezeny dvě různé struktury MeLi. Tetramer tvoří kubanovitý shluk se střídáním atomů uhlíku a lithia. Vzdálenosti Li-Li jsou 268 pm, téměř stejné jako u plynného dilithia. Vazby C-Li mají délku 231 pm. Každý uhlík je vázán na tři atomy H a tři atomy Li. Netěkavost (MeLi)4 a jeho nerozpustnost v alkanech jsou způsobeny agostickými interakcemi uvnitř shluků. U objemnějších shluků, jako je (terc-butylLi)4, mají větší vliv sterické efekty a tyto látky jsou jak těkavé, tak i rozpustné v alkanech.[6]
Označení: Li- fialová C- černá H- bílá
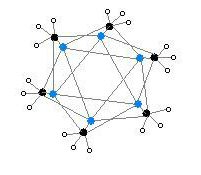
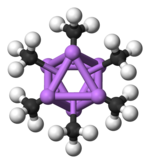
Hexamer vytváří šestiúhelníkové hranoly, kde se v jednotlivých vrcholech střídají atomy Li a C.
Označení: Li- fialová C- černá H- bílá
Míra shlukování, n u (MeLi)n, závisí na rozpouštědlu a na přítomnosti dalších látek (například bromidu lithného). V uhlovodíkových rozpouštědlech, jako je benzen, převažuje hexamer,[7] zatímco v etherech je hlavní formou tetramer.
Vazby
Shluky methyllithia mají „nedostatek elektronů“, neodpovídají oktetovému pravidlu, protože molekuly nemají na rozdíl od většiny organických sloučenin dostatečný počet elektronů, aby vytvořily čtyři dvoucenterované dvouelektronové vazby kolem každého uhlíku. Hexamer má 30 valenčních elektronů. Pokud se rozmístí 18 elektronů po silných vazbách C-H, tak jich na vazby Li-C a Li-Li zůstane 12. Celkem je potřeba šest elektronů na šest vazeb kov-kov a jeden na každou interakci methyl-η3lithium.
Energie vazeb C-Li je přibližně 240 kJ/mol.[7]
Reference
V tomto článku byl použit překlad textu z článku Methyllithium na anglické Wikipedii.
- ↑ a b c https://pubchem.ncbi.nlm.nih.gov/compound/2724049
- ↑ LUSCH, M. J.; PHILLIPS, W. V.; SIELOFF, R. F.; NOMURA, G. S.; HOUSE, H. O. Preparation of Low-Halide Methyllithium. Org. Synth.. 1984, s. 101. Dostupné online. (anglicky); Coll. Vol.. S. 346. (anglicky)
- ↑ Patrick L. Holland; Michael E. Smith; Richard A. Andersen; Robert G. Bergman. X-ray Crystal Structures of Cp*Ni(PEt3)X [X = Br, O(p-C6H4Me), NH(p-C6H4Me), S(p-C6H4Me), OCH3, CH2C6H5, Me, H, PEt3+]. Understanding Distortions and Trans Influences in Cyclopentadienyl Complexes. Journal of the American Chemical Society. 1997, s. 12815–12823. DOI 10.1021/ja971830o.
- ↑ B. H. Lipshutz; S. Sengupta. Organocopper Reagents: Substitution, Carbo/Metallocupration, and Other Reactions. Organic Reactions. 1992, s. 135–631. ISBN 9780471264187. DOI 10.1002/0471264180.or041.02.
- ↑ P. M. Morse; G. S. Girolami. Are d0 ML6 Complexes Always Octahedral? The X-ray Structure of Trigonal-Prismatic [Li(tmed)]2[ZrMe6]. Journal of the American Chemical Society. 1989, s. 4114–4116. DOI 10.1021/ja00193a061.
- ↑ C. Elschenbroich. Organometallics. Weinheim: Wiley-VCH, 2006. ISBN 978-3-527-29390-2.
- ↑ a b T. L. Brown; M. T. Rogers. The Preparation and Properties of Crystalline Lithium Alkyls. Journal of the American Chemical Society. 1957, s. 1859–1861. DOI 10.1021/ja01565a02.
Externí odkazy
 Obrázky, zvuky či videa k tématu Methyllithium na Wikimedia Commons
Obrázky, zvuky či videa k tématu Methyllithium na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Tetramer
chemical structure for methyl lithium
Hexamer