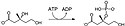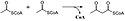Mevalonátová dráha

Mevalonátová dráha, také nazývaná isoprenoidová dráha nebo HMG-CoA reduktázová dráha je metabolická dráha přítomná u eukaryot, archeí a některých bakterií.[1] Vznikají při ní dva pětiuhlíkaté stavební prvky - isopentenylpyrofosfát (IPP) a dimethylallylpyrofosfát (DMAPP), které slouží k syntéze izoprenoidů, skupiny biomolekul, kam patří například cholesterol, vitamin K, koenzym Q10 a steroidní hormony.[2]
Výchozí látkou mevalonátové dráhy je acetylkoenzym A (acetyl-CoA) a konečnými produkty IPP a DMAPP.[3] Na mevalonátovou dráhu jsou zaměřena léčiva ze skupiny statinů, sloužící ke snižování koncentrace cholesterolu v krvi, která inhibují HMG-CoA-reduktázu, enzym, jenž je součástí této dráhy.
Svrchní část
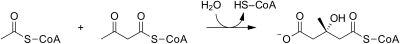
Mevalonátová dráha má u eukaryot, archeí i bakterií stejný začátek. Zdrojem uhlíku je acetyl-CoA. V prvním kroku kondenzují dvě molekuly acetyl-CoA na acetoacetyl-CoA. Následně dojde ke druhé kondenzaci, čímž vznikne HMG-CoA (3-hydroxy-3-methyl-glutaryl-CoA). Redukcí HMG-CoA se tvoří (R)-mevalonát. Tyto kroky se označují jako svrchní mevalonátová dráha.[4]
Spodní část
Spodní mevalonátová dráha přeměňuje (R)-mevalonát na IPP a DMAPP a má 3 varianty. U eukaryot je mevalonát dvakrát fosforylován v pozici 5-OH a poté dekarboxylován na IPP.[4] U některých archeí, jako je Haloferax volcanii, je mevalonát jednou fosforylován v pozici 5-OH, dekarboxylován na izopentenylfosfát (IP) a nakonec fosforylován za vzniku IPP, tato varianta se nazývá archeální mevalonátová dráha I.[5] Třetí variantou, popsanou například u Thermoplasma acidophilum, dochází k fosforylaci mevalonátu v pozici 3-OH a poté v pozici 5-OH. Vzniklý metabolit, mevalonát-3,5-bisfosfát, se dekarboxyluje na IP a nakonec fosforyluje na IPP (zde jde o archeální mevalonátovou dráhu I).[6][7]
Regulace
Existuje několik enzymů, které mohou být aktivovány transkripční regulací pomocí aktivace SREBP. Tento nitrobuněčný senzor detekuje nízké koncentrace cholesterolu a stimuluje jeho endogenní tvorbu v HMG-CoA reduktázové dráze, podobně jako navýšení vstřebávání lipoproteinů regulací LDL receptoru. Regulace této dráhy může také probíhat skrz ovlivňování translace mRNA, degradace reduktázy a fosforylace.[1]
Farmakologický význam
Na mevalonátovou dráhu se zaměřuje několik druhů léčiv:
- Statiny (snižují koncentraci cholesterolu v krvi);
- Bisfosfonáty (používané k léčbě kostních degenerativních onemocnění)
Vliv nemocí
Mevalonátovou dráhu ovlivňují tyto nemoci:
- Deficit mevalonátkinázy
- Mevalonová acidurie
- Hyperimunoglobulinemický D syndrom (HIDS).
Alternativní dráhy
Rostliny, většina bakterií a někteří prvoci mohou vytvářet izoprenoidy jiným způsobem nazývaným methylerythritolfosfátová (MEP) nebo nemevalonátová dráha.[8] Konečnými produkty mevalonátové i MEP dráhy jsou IPP a DMAPP, enzymatické reakce přeměňující acetyl-CoA na IPP jsou však odlišné. U vyšších rostlin MEP probíhá v plastidech, zatímco mevalonátová dráha v cytosolu.[8] K bakteriím využívajícím MEP dráhu patří například Escherichia coli a Mycobacterium tuberculosis.
Přehled reakcí
| Enzym | Reakce | Popis |
| Acetoacetyl-CoA thioláza |  | Acetyl-CoA (citrátový cyklus) kondenzuje s dalším acetyl-CoA za vzniku acetoacetyl-CoA |
| HMG-CoA syntáza | Acetoacetyl-CoA kondenzuje s acetyl-CoA na 3-hydroxy-3-methylglutaryl-CoA (HMG-CoA). | |
| HMG-CoA reduktáza |  | HMG-CoA je pomocí NADH redukován na mevalonát. Tento krok při syntéze cholesterolu určuje rychlost reakce, a proto je vhodným cílem léčiv (statinů). |
| Mevalonát-5-kináza | 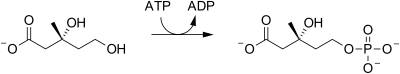 | Mevalonát je fosforylován v pozici 5-OH za vzniku mevalonát-5-fosfátu. |
| mevalonát-3-kináza | 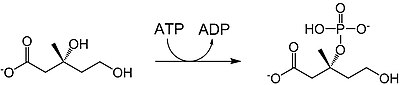 | Mevalonát je fosforylován na pozici 3-OH za tvorby mevalonát-3-fosfátu. Spotřebuje se jeden ekvivalent ATP. |
| mevalonát-3-fosfát-5-kináza |  | Mevalonát-3-fosfát je fosforylován na pozici 5-OH za vzniku fosfomevalonátu. Spotřebuje se jeden ekvivalent ATP. |
| fosfomevalonátkináza |  | Mevalonát-5-fosfát se fosforyluje na mevalonát-5-pyrofosfát. Spotřebuje se jeden ekvivalent ATP. |
| mevalonát-5-pyrofosfátdekarboxyláza |  | Mevalonát-5-pyrofosfát se dekarboxyluje za tvorby isopentenylpyrofosfátu (IPP). Spotřebuje se 1 ekvivalent ATP. |
| isopentenylpyrofosfátizomeráza | 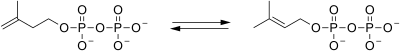 | Isopentenylpyrofosfát je izomerizován na dimethylallylpyrofosfát. |
Reference
V tomto článku byl použit překlad textu z článku Mevalonate pathway na anglické Wikipedii.
- ↑ a b BUHAESCU, Irina; IZZEDINE, Hassane. Mevalonate pathway: A review of clinical and therapeutical implications. Clinical Biochemistry. 2007-06, roč. 40, čís. 9-10, s. 575–584. Dostupné online [cit. 2025-01-31]. doi:10.1016/j.clinbiochem.2007.03.016. PMID 17467679. (anglicky)
- ↑ HOLSTEIN, Sarah A.; HOHL, Raymond J. Isoprenoids: Remarkable diversity of form and function. Lipids. 2004-04, roč. 39, čís. 4, s. 293–309. Dostupné online [cit. 2025-01-31]. ISSN 0024-4201. doi:10.1007/s11745-004-1233-3. PMID 15357017. (anglicky)
- ↑ GOLDSTEIN, Joseph L.; BROWN, Michael S. Regulation of the mevalonate pathway. Nature. 1990-02, roč. 343, čís. 6257, s. 425–430. Dostupné online [cit. 2025-01-31]. ISSN 0028-0836. doi:10.1038/343425a0. PMID 1967820. (anglicky)
- ↑ a b MIZIORKO, Henry M. Enzymes of the mevalonate pathway of isoprenoid biosynthesis. Archives of Biochemistry and Biophysics. 2011-01, roč. 505, čís. 2, s. 131–143. Dostupné online [cit. 2025-01-31]. doi:10.1016/j.abb.2010.09.028. PMID 20932952. (anglicky)
- ↑ DELLAS, Nikki; THOMAS, Suzanne T; MANNING, Gerard. Discovery of a metabolic alternative to the classical mevalonate pathway. eLife. 2013-12-10, roč. 2. Dostupné online [cit. 2025-01-31]. ISSN 2050-084X. doi:10.7554/eLife.00672. PMID 24327557. (anglicky)
- ↑ VINOKUR, Jeffrey M.; KORMAN, Tyler P.; CAO, Zheng. Evidence of a Novel Mevalonate Pathway in Archaea. Biochemistry. 2014-07-01, roč. 53, čís. 25, s. 4161–4168. Dostupné online [cit. 2025-01-31]. ISSN 0006-2960. doi:10.1021/bi500566q. PMID 24914732. (anglicky)
- ↑ AZAMI, Yasuhiro; HATTORI, Ai; NISHIMURA, Hiroto. (R)-Mevalonate 3-Phosphate Is an Intermediate of the Mevalonate Pathway in Thermoplasma acidophilum. Journal of Biological Chemistry. 2014-06, roč. 289, čís. 23, s. 15957–15967. Dostupné online [cit. 2025-01-31]. doi:10.1074/jbc.M114.562686. PMID 24755225. (anglicky)
- ↑ a b BANERJEE, A.; SHARKEY, T. D. Methylerythritol 4-phosphate (MEP) pathway metabolic regulation. Nat. Prod. Rep.. 2014, roč. 31, čís. 8, s. 1043–1055. Dostupné online [cit. 2025-01-31]. ISSN 0265-0568. doi:10.1039/C3NP70124G. PMID 24921065. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Mevalonátová dráha na Wikimedia Commons
Obrázky, zvuky či videa k tématu Mevalonátová dráha na Wikimedia Commons
Média použitá na této stránce
Autor: Uclasci1616, Licence: CC BY-SA 4.0
Podrobnější informace o vektorové grafice najdete na stránce Commons:Transition to SVG.
Také si můžete přečíst informace o podpoře formátu SVG v MediaWiki.
Autor: Vaccinationist, Licence: CC BY-SA 3.0
Phosphomevalonate kinase reaction.
5-phosphomevalonate + ATP → 5-pyrophosphomevalonate + ADP
Autor: Vaccinationist, Licence: CC BY-SA 3.0
Mevalonate kinase reaction.
mevalonate + ATP → 5-phosphomevalonate + ADP
Autor: Vaccinationist, Licence: CC BY-SA 3.0
HMG-CoA synthase reaction.
acetyl-CoA + acetoacetyl-CoA + H2O → 3-hydroxy-3-methylglutaryl-CoA + HS–CoA
Autor: Vaccinationist, Licence: CC BY-SA 3.0
Isopentenyl pyrophosphate isomerase (isopentenyl diphosphate δ-isomerase) reaction.
isopentenyl pyrophosphate ⇄ dimethylallyl pyrophosphate
Autor: Vaccinationist, Licence: CC BY-SA 3.0
HMG-CoA reductase reaction.
3-hydroxy-3-methylglutaryl-CoA + 2NADPH + 2H+ → mevalonate + HS–CoA + 2NADP+