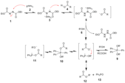
Micunobova reakce
Micunobova reakce je organická reakce, pomocí níž lze přeměnit alkoholy na mnoho jiných sloučenin, například estery, za použití trifenylfosfinu a azodikarboxylátu, například diethylazodikarboxylátu (DEAD) nebo diisopropylazodikarboxylátu (DIAD).[1] Přestože se nejčastěji používají DIAD a DEAD, tak lze použít i mnohé jiné azodikarboxyláty, čímž se v některých případech usnadňuje provedení reakce a/nebo přečištění produktů tím, že je možné použít zásaditější nukleofily.
Reakci objevil japonský chemik Ojo Micunobu. Nejčastěji se začíná přidáváním fosfinu a azodikarboxylátu při -10 °C do rozpouštědla, obvykle tetrahydrofuranu nebo toluenu, dokud se nevytvoří bílá sraženina ylidu. Následně se přidá roztok alkoholu a nukleofilu a mnohdy se reakční směs zahřívá. Alkohol reaguje s fosfinem za vzniku dobré odcházející skupiny, u které dojde k převrácení stereoizomerie SN2 mechanismem. Běžným vedlejším produktem je zde látka vznikající tehdy, když je odcházející skupina odštěpena azodikarboxylátem místo nukleofilu; k tomu dochází, pokud nukleofil není dostatečně kyselý nebo není dostatečně silným nukleofilem.

Tato reakce byla několikrát přezkoumána.[2][3][4][5][6]
Mechanismus
Mechanismus Micunobovy reakce je poměrně složitý, identita jednotlivých meziproduktů a jejich vliv na reakci dosud není jistý.
Na začátku trifenylfosfin 2 nukleofilně reaguje s azodikarboxylátem 1 za vzniku betainu 3, který deprotonuje karboxylovou kyselinu 4 na meziprodukt 5. DEAD následně deprotonuje alkohol 6, z něhož se vytvoří alkoxid, který se následně může přeměnit na oxyfosfoniový ion 8. Poměry množství a vzájemné přeměny meziproduktů 8–11 jsou ovlivňovány pKa karboxylové kyseliny a polaritou rozpouštědla.[7][8][9] V průběhu reakce se tvoří několik meziproduuktů obsahujících fosfor, avšak pouze reakce karboxylátového aniontu s meziproduktem 8 je produktivní reakcí, která vede ke vzniku konečného produktu 12 a trifenylfosfinoxidu 13.
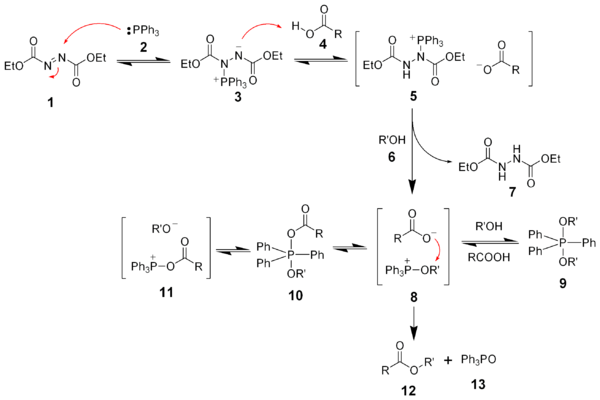
Bylo zjištěno, že tvorba dvojice iontů 5 probíhá rychle. Vznik oxyfosfoniového meziproduktu 8 je pomalý a probíhá díky přítomnosti alkoxidu. Na rychlost reakce tak má největší vliv kyselost karboxylátu a solvatace.[10]
Pořadí přidání reaktantů
Na průběh Micunobovy reakce může mít vliv i pořadí, v jakém jsou do reakční nádoby přidávány jednotlivé reaktanty. Nejčastěji se rozpustí alkohol, karboxylová kyselina a trifenylfosfin v tetrahydrofuranu (THF) nebo jiném vhodném rozpouštědle (například diethyletheru), směs se ochladí na 0 °C, pomalu se přidává DEAD rozpuštěný v THF a směs se několik hodin míchá při pokojové teplotě. Pokud reakce neproběhne, tak je vhodnější předpripravit betain, což se provede přidáním DEAD k trifenylfosfinu v THF při 0 °C, následným přimícháním alkoholu a nakonec karboxylové kyseliny.[11]
Podobné reakce
S jinými nukleofily
Jako nukleofily lze při Micunobově reakci použít i jiné látky než karboxylové kyseliny. K úspěšnému provedení reakce musí mít nukleofil pKa menší než 15.
| Nukleofil | Produkt |
|---|---|
| azoimid | alkylazid |
| imid | substituovaný imid[12] |
| fenol | alkylarylether[13][14] |
| sulfonamid | substituovaný sulfonamid[15] |
| arylsulfonylhydrazin | alkyldiazen[16] |
Obměny Micunobovy reakce
Za účelem usnadnění oddělení produktů a omezení tvorby odpadů bylo vyvinuto několik obměn původní Micunobocy reakce. V jedné z nich se používá trifenylfosfin navázaný na pryskyřici a di-terc-butylazodikarboxylát místo DEAD. Zoxidovanou trifenylfosfinovou pryskyřici lze odstranit filtrací a di-tert-butylazodikarboxylátový vedlejší produkt reakcí s kyselinou trifluoroctovou.[17] Bruce H. Lipshutz vyvinul jako náhradu k DEAD di-(4-chlorobenzyl)azodikarboxylát (DCAD), při jehož použití může být hydrazinový vedlejší produkt snadno odstraněn filtrací a přeměněn zpět na DCAD.[18]
Byla také popsána varianta, ve které byl DEAD použit v katalytickém množství, při ní bylo ovšem nutné použít stechiometrické množství (diacetoxyjod)benzenu, který oxidoval hydrazinový meziprodukt zpět na DEAD.[19]
Další variantou je redoxně neutrální Micunobova reakce, při níž je použit fosforitý katalyzátor, který aktivuje substrát, zajišťuje obrácení konfigurace při nukleofilním ataku, a vznikající voda se při ní odstraňuje pomocí Deanovy–Starkovy aparatury.[20]
S fosforanovými reaktanty

Trifenylfosfin a diethylazodikarboxylát lze při Micunobově reakci spojit do jednoho reaktantu, ylidu fosforanu. Dostatrčně účinné jsou jak (kyanomethylen)trimethylfosforan, tak i (kyanomethylen)tributylfosforan.[21]

Ylid zde funguje jako jako redukční činidlo, tak jako zásada. Vedlejšími produkty jsou acetonitril 6) a trialkyfosfinoxid (8).
Využití
Micunobovu reakci lze použít na přípravu aryletherů:[22]
Při této variantě se nepoužívá DEAD, protože je kvůli hydroxylové skupině příliš slabě kyselý, Místo toho se používá 1,1'-(azodikarbonyl)dipiperidin (ADDP), u kterého je příslušný betainový meziprodukt silnější zásadou. Fosfinovým reaktantem je zde trifenylfosfin navázaný na polymer.
Micunobova reakce také nachází využití při přípravě chininu, kolchicinu, sarainu, morfinu, stigmatellinu, eudistominu, oseltamiviru, strychninu a nufaraminu.[23]
Reference
V tomto článku byl použit překlad textu z článku Mitsunobu reaction na anglické Wikipedii.
- ↑ O. Mitsunobu; Y. Yamada. Preparation of Esters of Carboxylic and Phosphoric Acid via Quaternary Phosphonium Salts. Bulletin of the Chemical Society of Japan. 1967, s. 2380–2382.
- ↑ O. Mitsunobu. The Use of Diethyl Azodicarboxylate and Triphenylphosphine in Synthesis and Transformation of Natural Products. Synthesis. 1981, s. 1–28.
- ↑ B. R. Castro. Replacement of Alcoholic Hydroxy Groups by Halogens and Other Nucleophiles via Oxyphosphonium Intermediates. Organic Reactions. 1983, s. 1–162. ISBN 9780471264187.
- ↑ D. L. Hughes. The Mitsunobu Reaction. Organic Reactions. 1992, s. 335–656. ISBN 9780471264187.
- ↑ D. L. Hughes. The Mitsunobu Reaction. Organic Preparations and Procedures International. 1996, s. 127–164.
- ↑ K. C. K. Swamy; N. N. B. Kumar; E. Balaraman; K. V. P. P. Kumar. Mitsunobu and Related Reactions: Advances and Applications. Chemical Reviews. 2009, s. 2551–2651. PMID 19382806.
- ↑ E. Grochowski; B. D. Hilton; R. J. Kupper; C. J.Michejda. Mechanism of the triphenylphosphine and diethyl azodicarboxylate induced dehydration reactions (Mitsunobu reaction). The central role of pentavalent phosphorus intermediates. Journal of the American Chemical Society. 1982, s. 6876–6877.
- ↑ D. Camp; I. D. Jenkins. The mechanism of the Mitsunobu esterification reaction. Part I. The involvement of phosphoranes and oxyphosphonium salts. The Journal of Organic Chemistry. 1989, s. 3045–3049.
- ↑ D. Camp; I. D. Jenkins. The mechanism of the Mitsunobu esterification reaction. Part II. The involvement of (acyloxy)alkoxyphosphoranes. The Journal of Organic Chemistry. 1989, s. 3049–3054.
- ↑ D. L. Hughes; R. A. Reamer; J. J. Bergan; E. J. J. Grabowski. A mechanistic study of the Mitsunobu esterification reaction. Journal of the American Chemical Society. 1988, s. 6487–6491.
- ↑ R. Volante. A new, highly efficient method for the conversion of alcohols to thiolesters and thiols. Tetrahedron Letters. 1981, s. 3119–3122.
- ↑ HEGEDUS, L. S.; HOLDEN, M. S.; MCKEARIN, J. M. cis-N-TOSYL-3-METHYL-2-AZABICYCLO[3.3.0]OCT-3-ENE. Org. Synth.. 1984, s. 48. Dostupné online. (anglicky); Coll. Vol.. S. 501. (anglicky)
- ↑ Maghar S. Manhas; W. H. Hoffman; Bansi Lal; Ajay K. Bose. Steroids. Part X. A convenient synthesis of alkyl aryl ethers. J. Chem. Soc., Perkin Trans. 1. 1975, s. 461–463.
- ↑ Shmuel Bittner; Yonit Assaf. Use of activated alcohols in the formation of aryl ethers. Chemistry & Industry. 1975, s. 281.
- ↑ KUROSAWA, W.; KAN, T.; FUKUYAMA, T. PREPARATION OF SECONDARY AMINES FROM PRIMARY AMINES VIA 2-NITROBENZENESULFONAMIDES: N-(4-METHOXYBENZYL)-3-PHENYLPROPYLAMINE. Org. Synth.. 2002, s. 186. Dostupné online. (anglicky); Coll. Vol.. S. 482. (anglicky).
- ↑ Andrew G. Myers; Bin Zheng. New and Stereospecific Synthesis of Allenes in a Single Step from Propargylic Alcohols. Journal of the American Chemical Society. 1996, s. 4492–4493. ISSN 0002-7863.
- ↑ J. C. Pelletier; S. Kincaid. Mitsunobu reaction modifications allowing product isolation without chromatography: application to a small parallel library. Tetrahedron Letters. 2000, s. 797–800.
- ↑ B. H. Lipshutz; D. W. Chung; B. Rich; R. Corral. Simplification of the Mitsunobu Reaction. Di-p-chlorobenzyl Azodicarboxylate: A New Azodicarboxylate. Organic Letters. 2006, s. 5069–5072. PMID 17048845.
- ↑ T. Y. But; P. H. Toy. Organocatalytic Mitsunobu Reactions. Journal of the American Chemical Society. 2006, s. 9636–9637. PMID 16866510.
- ↑ Redox-neutral organocatalytic Mitsunobu reactions. Science. 2019-08-30, s. 910–914. ISSN 0036-8075.
- ↑ T. Tsunoda; C. Nagino; M. Oguri; S. Itô. Mitsunobu-type alkylation with active methine compounds. Tetrahedron Letters. 1996, s. 2459–2462.
- ↑ P. S. Humphries; Q. Q. T. Do; D. M. Wilhite; S. Itô. ADDP and PS-PPh3: an efficient Mitsunobu protocol for the preparation of pyridine ether PPAR agonists. Beilstein Journal of Organic Chemistry. 2006, s. 21. PMID 17076898.
- ↑ Mitsunobu Reaction at SynArchive Accessed April 26, 2014
Externí odkazy
 Obrázky, zvuky či videa k tématu Micunobova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Micunobova reakce na Wikimedia Commons
Média použitá na této stránce
Description: Reaction mechanism of the Mitsunobu reaction.
- Author, date of creation: selfmade by ~K, 02 April 2006.
- Source: -
- Copyright: Public domain. (PD)
- Comments: high-resolution PNG; ChemDraw / The GIMP.
(c) V8rik from en.wikipedia.org, CC BY-SA 3.0
Mitsunobu_reaction_Application
Reaction mechanism of the phosphorane variant of the Mitsunobu reaction.
chemical structure
Mitsunobu-Reaction