Mukaijamova totální syntéza taxolu
Mukaijamova totální syntéza taxolu je totální syntéza taxolu, kterou vyvinul Teruaki Mukaijama v letech 1997 až 1999.
Jedná se o lineární syntézu, při níž se cykly vytváří v pořadí C, B, A, D. Na rozdíl od ostatních popsaných postupů se zde vedlejší řetězec vytváří jedinečným způsobem. Součástí této syntézy je 5 aldolových reakcí a jsou do ní také zahrnuty pinakolové párování a Reformatského reakce. 20uhlíkatý řetězec se vytváří z L-serinu (C3), kyseliny isomáselné (C4), kyseliny glykolové (C2), brommethanu (C1), jodmethanu (C1), 2,3-dibrompropenu (C3), kyseliny octové (C2) a homoallylbromidu (C4).
Syntéza kruhu C
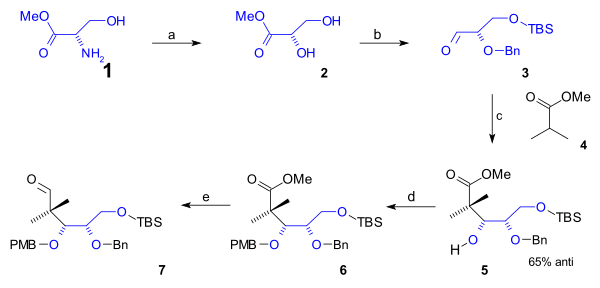
Spodní část cyklooktanového kruhu B zahrnuje prvních 5 atomů uhlíku připojených v částečné syntéze; jako výchozí materiál byl použit L-serin (obrázek 1). Na začátku byla převedena aminová skupina serinu na methylester (1) a následně ester diolu 2 diazotací za použití dusitanu sodného a kyseliny sírové). Po navázání chránicí skupiny (TBS, pomocí TBSCl a imidazolu) na primární alkohol a benzyletherové na sekundární alkohol (za použití benzylimidátu a kyseliny trifluormethansulfonové) reagoval aldehyd 3 s methylesterem kyseliny isomáselné (4) v aldolové adici za vzniku alkoholu 5 s 65% stereoselektivitou. Tato skupina byla ochráněna PMB (p-methoxybenzyl)etherem (znovu přes imidát) v kroku 6, čímž byla umožněna redukce esteru na aldehyd 7 s použitím diisobutylaluminiumhydridu.
| Obrázek 1 |
|---|
K dokončení tvorby cyklooktanu bylo potřeba přidat další 3 atomy uhlíku pomocí dvouuhlíkatého fragmentu aldolovou adicí a jednouhlíkatého Grignardova činidla (obrázek 2). Následovala Mukaijamova aldolová adice aldehydu 7 a ketensilylacetalu za přítomnosti bromidu hořečnatého a toluenu 8, kterou se se 71% stereoselektivitou tvořil alkohol 9; ten byl následně ochráněn převedením na TBS ether 10 s využitím TBSOTf a 2,6-lutidinu). Esterová skupina se redukovala disobutylaluminiumhydridem na alkohol a pak byla Swernovou oxidací převedena zpět na aldehyd 11. Alkylací na alkohol 12 pomocí methylmagnesiumbromidu a další Swernovou oxidací se vytvořil keton 13. Tato skupina se působením bis(trimethylsilyl)amidu lithného a TMSCl přeměnila na silylenolether 14, vzniklý produkt se zapojil do reakce s N-bromsukcinimidem (NBS) za vzniku alkylbromidu 15. Na C20 se navázala methylová skupina nukleofilní substituční reakcí s jodmethanem za přítomnosti silné zásady ([bis(trimethylsilyl)amidu lithného v hexamethylfosforamidu, HMPA) a vznikl bromid 16. Poté byla provedena příprava na uzavření kruhu, spočívající v odstranění TBS etherové skupinykyselinou chlorovodíkovou s tetrahydrofuranem (THF) a alkohol prošel Swernovou oxidací na aldehyd 17. Uzavření kruhu bylo uskutečněno prostřednictvím Reformatského reakce s jodidem samarnatým a kyselinou octovou za vzniku sloučeniny 18. Stereochemie tohoto kroku nebyla podstatná, protože acetátová skupina byla 1,8-diazabicyklo[5.4.0]undec-7-enem (DBU) v benzenu dehydratována na alken 19.
| Obrázek 2 |
|---|
Syntéza kruhu B
Pětiuhlíkatý fragment 24 nutný pro syntézu C kruhu (obrázek 3) vznikl z 2,3-dibrompropenu (20)[1] reakcí s ethylacetátem (21), n-butyllithiem a solí mědi, po níž následovala redukce acetátu 22 na alkohol 23 hydridem lithnohlinitým a následnou TES silylací. Michaelova reakce 24 s cyklooktanem a t-butyllithiem 19 za vzniku 25 byla katalyzována kyanidem měďným. Po odstranění TES skupiny pomocí HCl a THF byl alkohol 26 zoxidován na aldehyd 27 ruthenistanem tetrapropylamonným (TPAP) za přítomnosti N-methylmorfolin-N-oxidu (NMO), což umožnilo provést vnitromolekulární aldolovou reakci a tvorbu bicyklické sloučeniny 28.
| Obrázek 3 |
|---|
Syntéza kruhu A
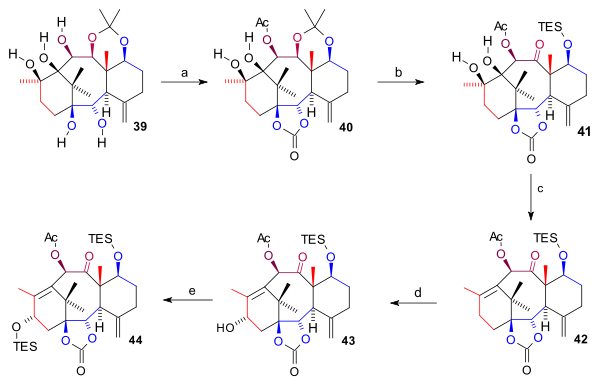
Syntéza kruhu A (obrázek 4) začíná redukcí devítiuhlíkatého ketonu 28 na diol 29 roztokem hydridu hlinitého v toluenu, následovalo navázání chránicí skupiny, karbonátu, na diol 30. Tímto byla umožněna selektivní oxidace alkoholu 2,3-dichlor-5,6-dikyano-1,4-benzochinonem (DDQ) po odstranění chránicí skupiny z ketonu 31. Vzniklá sloučenina byla alkylována Grignardovým činidlem (homoallylmagnesiumbromidem) na 32 a zbavena chránicí skupiny na C11 tetra-n-butylamoniumfluoridem za tvorby diolu 33. Reakcí s cyklohexylmethylsilyldichloridem vytvořily obě alkoholové skupiny cyklický silylether (34), jenž vstoupil do reakce s methyllithiem a vznikl tak 11uhlíkatý alkohol 35. Uzavření kruhu A vyžadovalo dvě ketonové skupiny zapojené do pinakolového párování, které se vytvořily oxidací tohoto alkoholu ruthenistanem tetrapropylamonia (TPAP) za přítomnosti N-methylmorfolin-N-oxidu (NMO) na 36 a Wackerovou oxidací allylu na diketon 37. Po vytvoření pinakolu 38 byly odstraněny benzylové skupiny sodíkem a amoniakem a po odštěpení trialkylsilylů tetra-n-butylamoniumfluoridem vznikl pentaol 39.
| Obrázek 4 |
|---|
Na pentaol 39 byly dvakrát navázány chránicí skupiny: dva hydroxyly jako estery kyseliny uhličité pomocí bis(trichlormethyl)karbonátu v pyridinu a navíc se C10 hydroxyl přeměnil na acetát; vznikl tak produkt 40. Byl odstraněn acetonid kyselinou chlorovodíkovou a tetrahydrofuranem, poté se C7 hydroxyl přeměnil na TES silylether a C11 hydroxyl se ruthenistanem tetrapropylamonia za přítomnosti NMO zoxidoval na keton 41. Odstranění diolu bylo provedeno kombinací eliminační reakce s Bartonovou–McCombieovou deoxygenací thiokarbonyldiimidazolem za vzniku alkenu 42. Nakonec byla do struktury zavedena C15 hydroxylová skupina dvoukrokovou oxidací allylu 4-fenyl-4-(1-piperidinyl)cyklohexanolem (PPC) a octanem sodným na enon, jenž působením K-selektridu vytvořil alkohol 43; ten byl ochráněn jako TES ether (44).
| Obrázek 5 |
|---|
Syntéza kruhu D
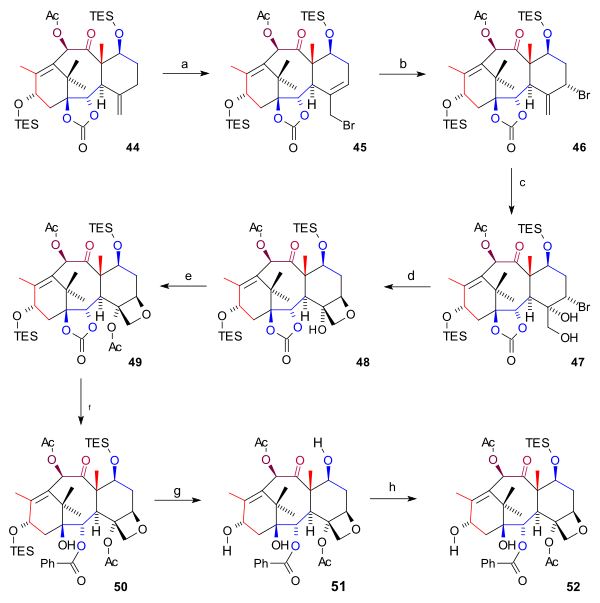
Při syntéze kruhu D (obrázek 6) byla prvním krokem allylová bromace sloučeniny 44 bromidem měďným a benzoyl-terc-butylperoxidu, jejímž produktem byl bromid 45. Další bromací se vytvořil bromid 46 (obě molekuly vytváří rovnováhu s atomem bromu v axiální poloze. Následně posloužil oxid osmičelý k tvorbě hydroxylových skupin na exocyklické dvojné vazbě diolu 47 a proběhlo uzavření oxetanového kruhu za vzniku 48 pomocí nukleofilní substituční reakce s 1,8-diazabicykloundec-7-enem (DBU). Poté byla provedena acylace C4 hydroxylu anhydridem kyseliny octové v 4-dimethylaminopyridinu (DMAP) a pyridinu a vznikl acetát 49. Nakonec byla s využitím fenyllithia otevřena esterová skupina, čímž se utvořil hydroxykarbonát 50 a obě TES skupiny byly odstraněny kyselinou fluorovodíkovou, čímž vznikl triol 51 (baccatin III) a C7 hydroxyl byl znovu ochráněn (52).
| Obrázek 6 |
|---|
Syntéza postranního řetězce
Syntéza amidového postranního řetězce (obrázek 7) byla založena na asymetrické aldolové reakci. Výchozí látkou byla kyselina benzyloxyoctová 53, která byla přeměněna na thioester 55 přes acylchlorid 54 (reakcí s chloridem thionylu). Poté silylenolether 56 vytvořený reakcí s n-butyllithiem a trimethylsilylchloridem v diisopropylaminu, reagoval v Mukaijamově aldolové adici s benzaldehydem a vytvořil alkohol 59 s 99% anti-selektivitou a 96% enantiomerním přebytkem. V následujícím kroku byl alkohol převeden na amin 60 Micunobovou reakcí (s azidovodíkem a diethylazodikarboxylátem za vzniku azidu a redukcí tohoto azidu trifenylfosfinem na amin. Pak následovaly benzoylace aminové skupiny benzoylchloridem (61) a hydrolytické oddělení thioetheru 62.
| Obrázek 7 |
|---|
V závěrečných krocích (obrázek 8) došlo k navázání amidového řetězce 62 na ABCD kruh 52 esterifikací katalyzovanou o,o'-di(2-pyridyl)thiokarbonátem (DPTC) a 4-dimethylaminopyridinem (DMAP), čímž byl získán ester 63. Benzylová chránící skupina byla odštěpena hydrogenací hydroxidem palladnatým na uhlíku (64) a TES reakcí s kyselinou fluorovodíkovou a pyridinem, čímž vznikl konečný produkt, taxol 65.
| Obrázek 8 |
|---|
Odkazy
Související články
- Totální syntéza taxolu
- Danishefského totální syntéza taxolu
- Holtonova totální syntéza taxolu
- Kuwadžimova totální syntéza taxolu
- Nicolaouova totální syntéza taxolu
- Wenderova totální syntéza taxolu
- Takahašiova totální syntéza taxolu
Externí odkazy
Literatura
- Teruaki Mukaiyama. Asymmetric Total Synthesis of Taxol Teruaki Mukaiyama , Isamu Shiina, Hayato Iwadare, Masahiro Saitoh, Toshihiro Nishimura, Naoto Ohkawa, Hiroki Sakoh, Koji Nishimura, Yu-ichirou Tani, Masatoshi Hasegawa, Koji Yamada , Katsuyuki Saitoh. Chemistry—A European Journal. 1999, s. 121–161. DOI 10.1002/(SICI)1521-3765(19990104)5:1<121::AID-CHEM121>3.0.CO;2-O. (anglicky)
Reference
V tomto článku byl použit překlad textu z článku Mukaiyama Taxol total synthesis na anglické Wikipedii.
- ↑ R. LESPIEAU AND M. BOURGUE. 2,3-Dibromopropene. Org. Synth.. 1941. Dostupné online. (anglicky); Coll. Vol.. S. 209. (anglicky)
Média použitá na této stránce
(c) V8rik at the English Wikipedia, CC BY-SA 3.0
Mukaiyama Taxol Overview