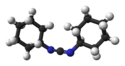
N,N'-dicyklohexylkarbodiimid
| N,N'-dicyklohexylkarbodiimid | |
|---|---|
 Strukturní vzorec | |
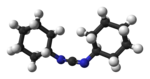 Model molekuly | |
| Obecné | |
| Systematický název | N,N′-dicyklohexylmethandiimin |
| Ostatní názvy | DCC |
| Sumární vzorec | C13H22N2 |
| Vzhled | bílé krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 538-75-0 |
| EC-no (EINECS/ELINCS/NLP) | 208-704-1 |
| PubChem | 10868 |
| SMILES | N(=C=N\C1CCCCC1)\C2CCCCC2 |
| InChI | InChI=1S/C13H22N2/c1-3-7-12(8-4-1)14-11-15-13-9-5-2-6-10-13/h12-13H,1-10H2 |
| Vlastnosti | |
| Molární hmotnost | 206,33 g/mol |
| Teplota tání | 34,5 °C (307,6 K)[1] |
| Teplota varu | 122 až 124 °C (395 až 397 K) (0,8 kPa)[1] |
| Rozpustnost ve vodě | rozkládá se[1] |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H302 H311 H317 H318[1] |
| P-věty | P261 P264 P270 P272 P280 P301+312 P302+352 P305+351+338 P310 P312 P321 P322 P330 P333+313 P361 P363 P405 P501[1] |
| Teplota vzplanutí | nad 113 °C (386 K)[1] |
Některá data mohou pocházet z datové položky. | |
N,N′-Dicyklohexylkarbodiimid (zkráceně DCC nebo DCCD)[2] je organická sloučenina se vzorcem (C6H11N)2C, používaná na spojování aminokyselin při umělé syntéze peptidů. Díky nízké teplotě tání lze tuto látku roztavit a tím usnadnit nakládání s ní. Rozpouští se v dichlormethanu, tetrahydrofuranu, acetonitrilu a dimethylformamidu, ve vodě je nerozpustná.
Struktura a spektroskopie
C-N=C=N-C jádro karbodiimidů (N=C=N) je lineární, se strukturou podobnou propadienu. Molekula je symetrická.
Skupinu N=C=N lze identifikovat pomocí infračervené spektroskopie, kde má charakteristickou absorpci při 2117 cm−1.[3] V 15N NMR má posun 275 ppm od kyseliny dusičné a 139 ppm od TMS.[4]
Příprava
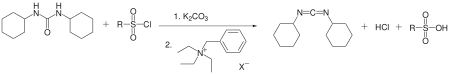
DCC se dá připravit několika způsoby. Jedním z nich je reakce cyklohexanaminu s isokyancyklohexanem za přítomnosti octanu palladnatého, jodu a kyslíku, která má výtěžnost 67 %.[5]
- C6H11NH2 + C6H11NC + O2 → (C6H11N)2C + H2O
Byla také popsána kondenzace dvou isokyanátů za použití OP(MeNCH2CH2)3N jako katalyzátoru, která má 92% výtěžnost:[3]
DCC lze rovněž připravit z dicyklohexylmočoviny s využitím katalyzátoru fázového přenosu. Dicyklohexylmočovina reaguje s arensulfonylchloridem a uhličitanem draselným v toluenu za přítomnosti benzyltriethylamoniumchloridu, přičemž se tvoří DCC s 50% výtěžností.[6]
Reakce
Tvorba amidů, esterů a peptidů
DCC lze použít jako dehydratační činidlo při přípravě amidů, ketonů a nitrilů.[2] Při těchto reakcich se DCC hydratuje na dicyklohexylmočovinu (DCU), která je nerozpustná ve většině organických rozpouštědel a nerozpouští se ani ve vodě. DCU lze tak oddělit filtrací, i když může být obtížné oddělit jejich zbytky od nepolárních látek. DCC lze použít k obrácení chirality sekundárních alkoholů. Při Steglichově esterifikaci se esterifikují alkoholy, i některé terciární, reakcí s karboxylovou kyselinou za přítomnosti DCC a katalytického množství 4-dimethylaminopyridinu.[7]
Při syntéze bílkovin (například s využitím fluorenylmethyloxykarbonylové skupiny se připojují aminokyseliny na N-konec peptidového řetězce; k navýšení elektrofility karboxylové skupiny se používá aktivace záporně nabitého kyslíku lepší odcházející skupinou, k tomuto účelu slouží DCC. Záporně nabitý kyslík se chová jako nukleofil, který reaguje s centrálním uhlíkem DCC. Tím dojde k napojení DCC na karboxylátovou skupinu, čímž vznikne vysoce elektrofilní meziprodukt, který usnadní nukleofilní reakci koncové aminoskupiny.
Pfitznerova-Moffattova oxidace
Za přítomnnosti dimethylsulfoxidu (DMSO) DCC usnadňuje Pfitznerovu-Moffattovu oxidaci.[8]
Tímto způsobem se oxidují alkoholy na aldehydy a ketony. Na rozdíl od oxidací řízených kovy, jako je Jonesova oxidace, při ní nedochází k „přeoxidování“ na karboxylové kyseliny. Obvykle se používají tři ekvivalenty DCC a 0,5 ekvivalentu zdroje protonů v DMSO. Reakce se ukončuje přidáním kyseliny.
Ostatní reakce
- Reakcí kyseliny s peroxidem vodíku za přítomnosti DCC vzniká peroxidová vazba
- Pomocí DCC lze dehydratovat i alkoholy. Při této reakci se nejprve tvoří O-acylmočovina jako meziprodukt, u kterého proběhne hydrogenolýza za vzniku alkenu:
- RCH(OH)CH2R' + (C6H11N)2C → RCH=CHR' + (C6H11NH)2CO
- Sekundární alkoholy mohou být přeměněny na opačný stereoizomer reakcí s esterem kyseliny mravenčí a následným zmýdelněním. Sekundární alkohol se smísí s DCC, kyselinou mravenčí a silnou zásadou, jako je například methoxid sodný.
Biologické účinky
DCC funguje jako inhibitor ATP syntázy,[9] váže se na jednu z jejich c podjednotek a stericky zabraňuje otočení FO podjednotky.[10]
Bezpečnost
DCC může způsobovat vyrážku.[2]
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu N,N'-dicyklohexylkarbodiimid na Wikimedia Commons
Obrázky, zvuky či videa k tématu N,N'-dicyklohexylkarbodiimid na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku N,N'-Dicyclohexylcarbodiimide na anglické Wikipedii.
- ↑ a b c d e f g h i Dicyclohexylcarbodiimide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b c Jeffrey S. Albert, Andrew D. Hamilton, Amy C. Hart, Xiaoming Feng, Lili Lin, Zhen Wang. 1,3‐Dicyclohexylcarbodiimide. EEROS. 2017, s. 1–9. ISBN 9780470842898. DOI 10.1002/047084289X.rd146.pub3.
- ↑ a b J. Tang; T. Mohan; J. G. Verkade. Selective and Efficient Syntheses of Perhydro-1,3,5-triazine-2,4,6-triones and Carbodiimides from Isocyanates Using ZP(MeNCH2CH2)3N Catalysts. Journal of Organic Chemistry. 1994, s. 4931–4938. DOI 10.1021/jo00096a041.
- ↑ I. Yavari; J. D. Roberts. Nitrogen-15 Nuclear Magnetic Resonance Spectroscopy. Carbodiimides. Journal of Organic Chemistry. 1978, s. 4689–4690. DOI 10.1021/jo00419a001.
- ↑ I. Pri-Bar; J. Schwartz. N,N-Dialkylcarbodiimide Synthesis by Palladium-Catalysed Coupling of Amines with Isonitriles. Chemical Communications. 1997, s. 347–348. DOI 10.1039/a606012i.
- ↑ Z. M. Jászay; I. Petneházy; L. Töke; B. Szajáni. Preparation of Carbodiimides Using Phase-Transfer Catalysis. Synthesis. 1987, s. 520–523. DOI 10.1055/s-1987-27992.
- ↑ B. Neises; W. Steglich. Esterification of Carboxylic Acids with Dicyclohexylcarbodiimide/4-Dimethylaminopyridine: Tert-Butyl Ethyl Fumarate. Organic Syntheses. 1985, s. 183. DOI 10.1055/s-1987-27992.
- ↑ John G. Moffatt. Cholane-24-al. Organic Syntheses. 1967, s. 25. DOI 10.15227/orgsyn.047.0025.
- ↑ S. Hong; P. L. Pedersen. ATP synthase and the actions of inhibitors utilized to study its roles in human health, disease, and other scientific areas. Microbiology and Molecular Biology Reviews. 2008, s. 590–641. DOI 10.1128/MMBR.00016-08. PMID 19052322.
- ↑ M. Toei; H. Noji. Single-molecule analysis of F0F1-ATP synthase inhibited by N,N-dicyclohexylcarbodiimide. Journal of Biological Chemistry. 2013, s. 25 717 – 25 726. DOI 10.1074/jbc.M113.482455. PMID 23893417.
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Autor: Smokefoot, Licence: CC BY-SA 4.0
structure of Dicyclohexylcarbodiimide
Dicyclohexylcarbodiimide synthesis
Ball-and-stick model of the DCC molecule
Dicyclohexylcarbodiimide synthesis from cyclohexyl isocyanate