Názvosloví koordinačních sloučenin
Názvosloví pro komplexní sloučeniny vytváří Mezinárodní unie pro čistou a užitou chemii (anglicky International Union of Pure and Applied Chemistry, zkráceně IUPAC). Poslední úprava názvosloví koordinačních sloučenin byla navržena v roce 2004[1] a byla zahrnuta do názvoslovných doporučení anorganické chemie IUPAC 2005 (tzv. Red Book)[2], do češtiny byly tyto změny přeloženy v létě roku 2007, ale ještě[kdy?] nejsou oficiálně vydány.[3]
Název koordinační sloučeniny
Koordinační (komplexní) sloučenina je sloučenina, která obsahuje komplexní částici. Ta může být v podobě kationtu, aniontu nebo elektroneutrální částice. Postup je analogický jako při tvorbě názvu anorganické sloučeniny. Na prvním místě je název aniontové částice ve tvaru podstatného jména, jako druhý je kation ve tvaru přídavného jména. Není rozhodující náboj centrálního atomu, ale celé komplexní částice, která se píše do hranaté závorky []. Název aniontu i kationtu se tvoří přidáním názvů jednotlivých ligandů s příslušnou předponou vyjadřující množství před název centrálního atomu. Ligandy se řadí dle abecedního pořadí jejich názvu (předpona pro množství se do základního názvu nepočítá) a jejich názvy se oddělují spojovníkem –, mezi posledním ligandem a centrálním atomem se pomlčka smí udělat, ale není to nutné. Elektroneutrální komplex se skládá ze slova „komplex“ a názvu dané částice ve tvaru přídavného jména.
Název centrálního atomu
Název centrálního atomu se v případě kationtové a aniontové částice tvoří stejně jako název solí. Tedy kořen prvku a přípona pro dané oxidační číslo. Název centrálního atomu v elektroneutrální částici má kationtový tvar.
Kationty
V tabulce jsou uvedeny názvy některých centrálních atomů pro sloučeniny pro příslušná oxidační čísla. V případě použití samostatného kationtu přidáme k názvu slovo „kation“ (např. „…železitý kation“ či „kation …železitý“).
| Centrální atom | M1+ | M2+ | M3+ | M4+ | M5+ | M6+ | M7+ | M8+ |
|---|---|---|---|---|---|---|---|---|
| Přípona | -ný | -natý | -itý | -ičitý | -ičný/-ečný | -ový | -istý | -ičelý |
| Příklady | Manganný | Měďnatý | Zlatitý | Titaničitý | Vanadičný | Železový | Rhenistý | Rutheničelý |
| Měďný | Manganatý | Železitý | Kobaltičitý | Niobičný | Molybdenový | Osmistý | Osmičelý | |
| Stříbrný | Železnatý | Kobaltitý | Zirkoničitý | Tantaličný | Manganový | Ruthenistý | - | |
| Rtuťný | Zinečnatý | Chromitý | Manganičitý | Rutheničný | Wolframový | Technecistý | - | |
| Zlatný | Rtuťnatý | Manganitý | Nikličitý | Iridičný | Rhenový | Manganistý | - |
Anionty
V tabulce jsou uvedeny názvy některých centrálních atomů pro sloučeniny pro příslušná oxidační čísla. V případě použití samostatného aniontu přidáme k názvu slovo „anion“ (např. „…železitanový anion“ či „anion …železitanový“).
| Centrální atom | M1+ | M2+ | M3+ | M4+ | M5+ | M6+ | M7+ | M8+ |
|---|---|---|---|---|---|---|---|---|
| Přípona | -nan | -natan | -itan | -ičitan | -ičnan/-ečnan | -an | -istan | -ičelan |
| Příklady | Mangannan | Měďnatan | Zlatitan | Titaničitan | Vanadičnan | Železan | Rhenistan | Rutheničelan |
| Měďnan | Manganatan | Železitan | Kobaltičitan | Niobičnan | Molybdenan | Osmistan | Osmičelan | |
| Stříbrnan | Železnatan | Kobaltitan | Zirkoničitan | Tantaličnan | Manganan | Ruthenistan | - | |
| Rtuťnan | Zinečnatan | Chromitan | Manganičitan | Rutheničnan | Wolframan | Technecistan | - | |
| Zlatnan | Rtuťnatan | Manganitan | Nikličitan | Iridičnan | Rhenan | Manganistan | - |
Název ligandu
Názvy anorganických ligandů
Jak už bylo uvedeno, názvosloví některých anorganických ligandů prodělalo změnu, staré názvosloví se sice smí používat, ale bylo by lepší se naučit nové názvosloví co nejdříve. V tabulce jsou uvedeny názvy základních anorganických ligandů a pro srovnání i staré názvy.
Při tvorbě názvu ligandu vycházíme z latinského názvu částice koordinované k centrálnímu atomu. U aniontů se k tomuto názvu ještě přidává přípona -o. Ligandy mohou být buď jednovazné nebo vícevazné. Vaznost ale nemá nic společného s nábojem ligandu. Téměř všechny ligandy uvedené v tabulce jsou za běžných podmínek jednovazné (dvouvazné jsou SO 2-
4 , NO -
3 a PO 3-
4 ). Některé ligandy, jako například karbonyl, mohou v určitých komplexech vystupovat jako můstkové ligandy, ale jen proto je nelze považovat za vícevazné.
| Ligand | Nový název | Starý název | Ligand | Název | Ligand | Název | ||
|---|---|---|---|---|---|---|---|---|
| F− | Fluorido | Fluoro | H2O | Aqua | NO - 2 | Nitro | ||
| Cl− | Chlorido | Chloro | NH3 | Ammin | O2H− | Hydroperoxo | ||
| Br− | Bromido | Bromo | CO | Karbonyl | NH2− | Imido | ||
| I− | Jodido | Jodo | NO | Nitrosyl | ONO− | Nitrito | ||
| OH− | Hydroxido | Hydroxo | O2− | Oxido | PO 3- 4 | Fosfato | ||
| CN− | Kyanido | Kyano | S2− | Thio | NH - 2 | Amido | ||
| SCN− | thiokyanato rhodanido | thiokyanato rhodano | SO 2- 4 | Sulfato | SO 2- 3 | Sulfito | ||
| O 2- 2 | Peroxido | Peroxo | NO - 3 | Nitrato | CO 2- 3 | Karbonato | ||
| H− | Hydrido |
Názvy organických ligandů
Názvosloví organických ligandů se oproti anorganickým nezměnilo. Při vyslovování celého názvu komplexu se sice může použít celý název organického ligandu, ale při zapisování sumárního vzorce komplexu se celý název ve většině případů nepoužívá. Místo něj se často používá zkratka daného ligandu. V tabulce jsou proto uvedeny systematické názvy, zkratky některých ligandů a modely organických ligandů.
| Systematický název | Dentacita (vaznost) | Zkratka | Vzorec | Náhled prostorového modelu |
|---|---|---|---|---|
| Ethylendiamin | 2 | en |  | |
| Diethylentriamin | 3 | dien |  | 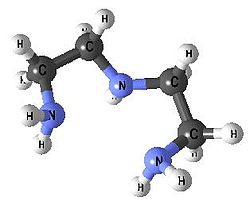 |
| Triethylentetraamin | 4 | trien |  | |
| Terpyridin | 3 | terpy |  |  |
| 1,10-fenantrolin | 2 | phen |  |  |
| o-fenylenbis(dimethylarsan) | 2 | diars |  | |
| Acetylacetonát | 2 | acac |  |  |
| Ethylendiamintetraoctová kyselina | 6 | edta | 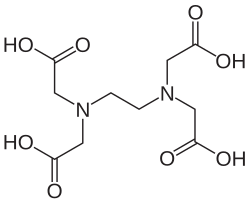 |  |
| Pyridin | 1 | py |  | 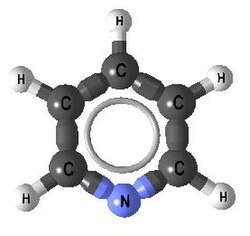 |
| Bipyridyl (2,2'-bipyridin) | 2 | bipy, bpy |  |  |
| Tropolonát | 2 |  | ||
| Oxalát | 2 | ox, (C2O4)2− |  | 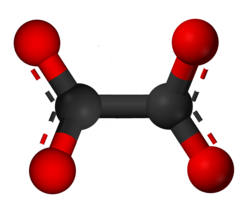 |
| N,N-ethylenbis(salicylideniminát) | 4 |  | ||
| Ftalokyanin | 4 |  | ||
| Propan-1,3-diamin | 2 | tn | 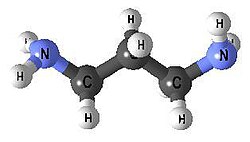 | |
| 2,6-diacetylpyridinbis(hydrazon) kyseliny benzoové | 5 | dapbah |  | |
| 1,8-naftyridin | 2 | naph |  | |
| Trimethylfosfin | 1 | PMe3 | 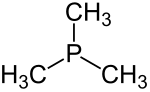 | 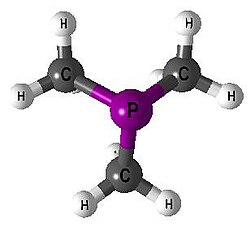 |
| Trifenylfosfin | 1 | PPh3 |  |  |
| 1,2-fenylenbis((2-dimethylarsanofenyl) -methylarsan) | 4 | tpas |  | |
| Tetrahydrofuran | 1 | thf | 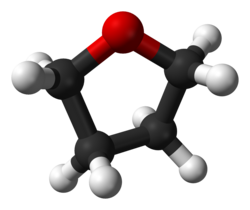 | |
| Ethylenbis(3-(dimethylarsano)propyl(fenyl)arsan) | 4 | tetars |  | |
| 8-hydroxychinolin | 2 | oxin |  | |
| 5-methyl-8-hydroxychinolin | 2 | chin |  | |
| 1,2-bis(methylsulfanyl)ethan | 2 | dth |  | |
| Ethan-1,2-diylbis(difenylfosfan) | 2 | dppe |  | |
| 2,6-diacetylpyridinbis(benzohydrazon) | 4 | dapbh |  |
Vyjadřování množství ligandu
Množství ligandů se vyjadřuje pomocí dvou druhů číslovkových předpon – pomocí základních číslovkových předpon a pomocí násobných číslovkových předpon – každý druh se užívá jindy:
- Základní číslovkové předpony se používají u jednoduchých anorganických ligandů jako je Cl−, F−, CN−, atd., obecně u ligandů, v jejich názvu není základní číslovková předpona již obsažena nebo nemůže dojít ke zkreslení názvu ligandu. Název ligandu se do kulatých závorek nepíše.
- Násobné číslovkové předpony se používají u složitých anorganických ligandů jako je SO 2-
4 , CO 2-
3 , NO -
3 , atd., obecně u ligandů, jejichž název již obsahuje základní číslovkovou předponu (např. ethylendiamin) nebo by mohlo dojít ke zkreslení názvu ligandu (difosfát (P2O7)4− × bis(fosfát) (PO 3-
4 )2). Název ligandu se dává do kulaté závorky ().
I když se základní číslovkové předpony používají pro jednoduché anorganické ligandy a z větší části také pro organické ligandy, není hranice mezi jednoduchými a složitými ligandy ostrá, proto pokud si při pojmenovávání není někdo jistý, je lepší použít násobné číslovkové předpony. V následující tabulce jsou vypsány názvy základních a násobných číslovkových předpon:
| Počet ligandů | Základní číslovková předpona | Násobná číslovková předpona |
|---|---|---|
| 1 | mono- (nepíše se) | - |
| 2 | di- | bis- |
| 3 | tri- | tris- |
| 4 | tetra- | tetrakis- |
| 5 | penta- | pentakis- |
| 6 | hexa- | hexakis- |
| 7 | hepta- | heptakis- |
| 8 | okta- | oktakis- |
| 9 | nona- | nonakis- |
| 10 | deka- | dekakis- |
| 11 | undeka- | undekakis- |
| 12 | dodeka- | dodekakis- |
| 13 | trideka- | tridekakis- |
| 14 | tetradeka- | tetradekakis- |
| 15 | pentadeka- | pentadekakis- |
| 16 | hexadeka- | hexadekakis- |
Příklady užití názvosloví
Názvosloví komplexních sloučenin se běžně používá pro veškeré komplexy. Pro život běžného chemika je znalost alespoň základního názvosloví komplexů nezbytná. Kromě systematického názvosloví se používá také triviální názvosloví. To sice nemá žádná pravidla, ale jeho používání je naprosto běžné, takže pro chemiky je v podstatě nezbytnější než systematické. Nelze ho ale použít pro všechny sloučeniny, protože ne všechny komplexy mají nějaký triviální název.
- K3[Fe(CN)5(NO)] – pentakyanido-nitrosylželeznatan draselný
- Fe4[Fe(CN)6]3 – hexakyanidoželeznatan železitý – berlínská modř, Turnbullova modř
- K3[Fe(CN)6] – hexakyanidoželezitan draselný – červená krevní sůl
- K4[Fe(CN)6] – hexakyanidoželeznatan draselný – žlutá krevní sůl
- Na2[Fe(CN)5(NO)] – pentakyanido-nitrosylželezitan sodný – nitroprussid sodný
- K3[Co(NO2)6] – hexanitrokobaltitan draselný – Fischerova sůl
- [Cu(NH3)4](OH)2 – hydroxid tetraamminměďnatý – Schweizerovo činidlo
- [Pt(NH3)4][PtCl4] – tetrachloridoplatnatan tetraamminplatnatý
- [NiBr2Cl2]2− – aniont dibromido-dichloridonikelnatý
- [Fe(bipy)2Cl2] – komplex bis(bipyridyl)-dichloridoželeznatý
- [Fe(H2O)5(SCN)]2+ – kationt pentaaqua-rhodanidoželezitý
- [Cr(H2O)2(en)2]Cl3 – chlorid diaqua-bis(ethylendiamin)chromitý
- [Cr(NH3)6][Co(CN)6] – hexa(kyano)kobaltitan hexaamminchromitý
- [Co(en)2(NO2)2]+ – kationt bis(ethylendiamin)-dinitrokobaltitý
- [Co(en)2(ONO)2]+ – kationt bis(ethylendiamin)-dinitritokobaltitý
- [PtCl2(NH3)4][PtCl4] – tetrachloridoplatnatan tetraammin-dichloridoplatničitý
Odkazy
Reference
- ↑ IUPAC Provisional Recommendation - Nomenclature of Inorganic Chemistry (2004) Archivováno 27. 10. 2006 na Wayback Machine. (anglicky) - IR-9 Coordination Compounds
- ↑ Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005 Archivováno 30. 11. 2007 na Wayback Machine. (anglicky) - PDF verze ke stažení
- ↑ Podle e-mailové konverzace mezi Ondřejem Manglem a RNDr. Janem Kotkem, Ph.D. z katedry anorganické chemie PřF UK.
Literatura
- Dr. Heinrich Remy, Anorganická chemie 2. díl, 1. vydání 1961
- N. N. Greenwood – A. Earnshaw, Chemie prvků 2. díl, 1. vydání 1993 ISBN 80-85427-38-9
- Jursík F.: Anorganická chemie kovů. 1. vyd. 2002. ISBN 80-7080-504-8 (elektronická verze)
Související články
Média použitá na této stránce
1,8-naftyridin
Bipyridyl - bipy
8-hydroxychinolin - oxin
Acetylacetonát - acac
Structure of pyridine
Structure of Oxalic acid
Terpyridin - terpy
Ball-and-stick model of triphenylphosphine, as found in crystalline form. X-ray crystallographic data from B. J. Dunne and A. G. Orpen (1991). "Triphenylphosphine: a redetermination". Acta Crystallographica Section C 47: 345-347. DOI:10.1107/S010827019000508X.
Skeletal formula of triphenylphosphine, PPh3.
Structure drawn in ChemDraw Ultra 11.0.5-methyl-8-hydroxychinolin - chin
chemical structure of 1,10-phenanthroline
Ethylendiamin - en
Oxalate anion molecule model
1,10-fenantrolin - phen
Dppe
propan-1,3-diamin - tn
Strukturformel von Trimethylphosphin
Diethylentriamin - dien
Structure of N1,N1'-(ethane-1,2-diyl)bis(ethane-1,2-diamine)
Structural formula of the chemical compound 2,2'-Bipyridine (bipyridyl, dipyridine, dipyridyl)
Structure of acetylacetone
trimethylfosfin - pme
Autor: unknown, Licence:
Ftalocyanin
Ball-and-stick model of the zwitterionic ethylenediaminetetraacetic acid molecule, as found in the crystalline β-form.
Structure determined by X-ray diffraction data reported in Acta Cryst. B (1972) 28, 781-785
Colour code:
- Carbon, C: grey-black
- Hydrogen, H: white
- Nitrogen, N: blue
- Oxygen, O: red
Terpyridine; 2,2',2-terpyridine; 2,2',2-Tripyridine
Chemical structure of 1,3-diaminopropane
tetars
Structure of ethane-1,2-diamine
Pyridin - py
2,6-diacetylpyridinbis(benzohydrazon) - dapbh
Tropolonát
Dth
2,6-diacetylpyridinbis(hydrazon) kyseliny benzoové - dapbah
Structure of N1-(2-aminoethyl)ethane-1,2-diamine
Structure of EDTA
Ball-and-stick model of the 1,2-bis(dimethylarsino)benzene molecule, C10H16As2, more commonly known as diars.
Colour code:
- Carbon, C: black
- Hydrogen, H: white
- Arsenic, As: purple
Structure calculated with Spartan Student 4.1, using the Hartree-Fock level of theory and the 3-21G basis set.
Image generated in Accelrys DS Visualizer.N,N-ethylenbis(salicylideniminát)
Ball-and-stick model of the tetrahydrofuran molecule. Structure calculated in Spartan using the HF/3-21G basis set.
Triethylentetraamin







































