N-Methylimidazol
| N-methylimidazol | |
|---|---|
 Strukturní vzorec | |
 Tyčinkový model molekuly | |
 Kalotový model molekuly | |
| Obecné | |
| Systematický název | 1-Methyl-1H-imidazol |
| Ostatní názvy | NMI |
| Sumární vzorec | C4H6N2 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 616-47-7 |
| EC-no (EINECS/ELINCS/NLP) | 210-484-7 |
| PubChem | 1390 |
| SMILES | c1cc(cc(c1)N)N |
| InChI | 1/C6H8N2/c7-5-2-1-3-6(8)4-5/h1-4H,7-8H2 |
| Vlastnosti | |
| Molární hmotnost | 82,104 g/mol |
| Teplota tání | −6,0 °C (267,2 K)[1] |
| Teplota varu | 195,5 °C (468,6 K)[1] |
| Hustota | 1,03 g/cm3 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H302 H312 H314[1] |
| P-věty | P260 P264 P270 P280 P301+312 P301+330+331 P302+352 P303+361+353 P304+340 P305+351+338 P310 P312 P321 P322 P330 P363 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
1-Methylimidazol, také nazývaný N-methylimidazol, je aromatická heterocyklická sloučenina se vzorcem CH3C3H3N2. Jedná se o bezbarvou kapalinu používanou jako rozpouštědlo, zásada a jako prekurzor některých iontových kapalin. N-methylimidazolové skupiny jsou součástmi řady nukleosidů i histidinu a histaminu.
Zásaditost
Vzhledem k methylové skupině navázané na dusík tento derivát imidazolu nemůže tvořit tautomery. Je poněkud silnější zásadou než imidazol, pKa konjugovaných kyselin činí 7,0 a 7,4.[2] Methylace také výrazně snižuje teplotu tání, díky čemuž lze 1-methylimidazol použít jako rozpouštědlo.
Výroba
1-Methylimidazol se vyrábí dvěma postupy. Prvním z nich je kysele katalyzovaná methylace imidazolu methanolem. Druhý způsob spočívá v Radziszewského reakci glyoxalu, formaldehydu a směsi amoniaku s methylaminem.[3][4]
- (CHO)2 + CH2O + CH3NH2 + NH3 → H2C2N(NCH3)CH + 3 H2O
V laboratoři jej lze připravit methylací imidazolu následovanou deprotonací;[5] lze také nejprve provést deprotonaci imidazolu za vzniku sodné soli a až poté methylaci.[6][7]
- H2C2N(NH)CH + CH3I → [H2C2(NH)(NCH3)CH]I
- [H2C2(NH)(NCH3)CH]I + NaOH → H2C2N(NCH3)CH + H2O + NaI
Použití
V laboratořích se 1-methylimidazol a jeho deriváty používají jako napodobeniny biomolekul obsahujících imidazolové skupiny.
1-Methylimidazol je též prekurzorem při syntéze methylimidazolových monomerů používaných na výrobu pyrrol-imidazolových polyamidů. Tyto polymery se mohou selektivně vázat na určité sekvence DNA způsobem závislým na konkrétní sekvenci.[8]
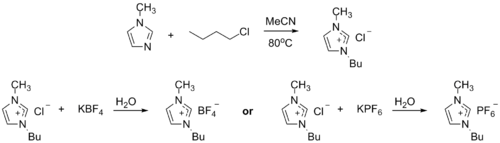
Prekurzor iontových kapalin
1-Methylimidazol může být alkylován na dialkylimidazoliové soli. V závislosti na použitém alkylačním činidlu a protianiontu se mohou tvořit různé iontové kapaliny, například 1-butyl-3-methylimidazoliumhexafluorofosfát ("BMIMPF6"):[9][10]
1-methylimidazole lze použít k odstranění kyselin při výrobě diethoxyfenylfosfinu. V tomto procesu reaguje 1-methylimidazol s HCl za vzniku 1-methylimidazoliumhydrochloridu, který se za podmínek reakce samovolně odděluje jako samostatná kapalná fáze.[9][11]
- 2 MeC3N2H3 + C6H5PCl2 + 2 C2H5OH → 2 [MeC3N2H4]Cl + C6H5P(OC2H5)2
Donorové vlastnosti
1-methylimidazolový (NMIz) ligand vytváří oktaedrické ionty M(NMIz)62+ (M = Fe, Co, Ni a čtvercový ion Cu(NMIz)42+).[12]
1-methylimidazol reaguje za vzniku aduktů s Lewisovými kyselinami, jako jsou molybdenperfluorobutyrát a [Rh(CO)2Cl]2. Vlastnosti 1-methylimidazolu jako donoru byly analyzovány pomocí ECW modelu, přičemž EB= 1,16 a CB= 4,92.
Odkazy
Související články
- 2-Methylimidazol
- 4-Methylimidazol
Externí odkazy
 Obrázky, zvuky či videa k tématu N-Methylimidazol na Wikimedia Commons
Obrázky, zvuky či videa k tématu N-Methylimidazol na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku 1-Methylimidazole na anglické Wikipedii.
- ↑ a b c d e f 1-Methylimidazole. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Albert, A., Heterocyclic Chemistry, 2nd ed.; 1968 Athlone Press, ISBN 0-485-11092-X
- ↑ Ullmann's Encyclopedia of Industrial Chemistry. Příprava vydání Wiley-VCH. 1. vyd. [s.l.]: Wiley Dostupné online. ISBN 978-3-527-30385-4, ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a13_661. (anglicky) DOI: 10.1002/14356007.
- ↑ Bronislaw Radziszewski. Ueber die Constitution des Lophins und verwandter Verbindungen. Berichte der deutschen chemischen Gesellschaft. 1882, s. 1493–1496. Dostupné online. DOI 10.1002/cber.18820150207.
- ↑ Gilchrist, T. L., Heterocyclic Chemistry, 2nd ed.; 1992 Longman Scientific & Technical, ISBN 0-582-06420-1
- ↑ Grimmett, M. R., Imidazole and Benzimidazole Synthesis; 1997 Academic Press, ISBN 0-12-303190-7
- ↑ Gupta, R. R., Kumar, M., Gupta, V., Heterocyclic Chemistry II: Five Membered Heterocycles; 1999 Springer, ISBN 3-540-65252-3
- ↑ Eldon E. Baird; Peter B. Dervan. Solid Phase Synthesis of Polyamides Containing Imidazole and Pyrrole Amino Acids. Journal of the American Chemical Society. 1996, s. 6141–6146. Dostupné online. DOI 10.1021/ja960720z.
- ↑ a b G. Wytze Meindersma; Matthias Maase; André B. De Haan. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2007. ISBN 978-3-527-30673-2. DOI 10.1002/14356007.l14_l01. Kapitola Ionic Liquids.
- ↑ DUPONT, J.; CONSORTI, C.; SUAREZ, P.; DE SOUZA, R. Preparation of 1-Butyl-3-methyl imidazolium-based Room Temperature Ionic Liquids. Org. Synth.. 2004. Dostupné online. (anglicky); Coll. Vol.. S. 184. (anglicky)
- ↑ Tom Welton. Solvents and sustainable chemistry. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 2015-11-11, s. 20150502. DOI 10.1098/rspa.2015.0502. PMID 26730217.
- ↑ R. Reedijk. Pyrazoles and imidazoles as ligands. II. Coordination compounds of N-methyl imidazole with metal perchlorates and tetrafluoroborates. Inorganica Chimica Acta. 1969, s. 517–522. DOI 10.1016/S0020-1693(00)92544-1.
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
figure of methylimidazole as ionic liquid precursor
Chemical diagram for 1-methylimidazole
Autor: PishT, Licence: CC BY-SA 4.0
1-Methylimidazole Ball and Stick