Butyllithium
| Butyllithium | |
|---|---|
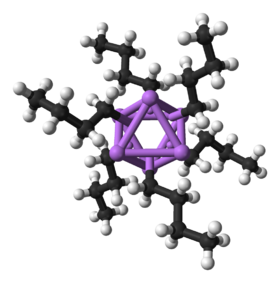 hexamer butyllithia | |
| Obecné | |
| Systematický název | Butyllithium |
| Anglický název | Butyllithium |
| Německý název | Butyllithium |
| Funkční vzorec | CH3CH2CH2CH2Li |
| Sumární vzorec | C4H9Li |
| Vzhled | Bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 109-72-8 |
| PubChem | 61028 |
| SMILES | CCCC[Li] |
| InChI | InChI=1/C4H9.Li/c1-3-4-2;/h1,3-4H2,2H3;/rC4H9Li/c1-2-3-4-5/h2-4H2,1H3 |
| Vlastnosti | |
| Molární hmotnost | 64,06 g/mol |
| Teplota tání | −76 °C |
| Teplota varu | rozklad |
| Hustota | 0,680 g/cm3 |
| Rozpustnost ve vodě | reaguje s vodou, rozpustné v diethyletheru |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
Některá data mohou pocházet z datové položky. | |
Butyllithium (C4H9Li) je organokovová sloučenina lithia a butanu. Je nestabilní.
Použití
Butyllithium se většinou používá jako roztok. Je také dostupné jako nejčastěji 15% nebo 25% roztok v alkanech (pentan, hexan nebo heptan), roztok je většinou světle žlutý. Byly také připraveny roztoky v diethyletheru a tetrahydrofuranu, ale nejsou dostatečně stabilní.
Používá se jako iniciátor polymerizace elastomerů, například polybutadienu a butadien-styrenových kaučuků. Také se používá jako silná zásada v organické syntéze v chemickém průmyslu i v laboratoři.
Převážně se používá pro anionickou polymerizaci dienů, například buta-1,3-dienu:
C4H9Li + CH2=CH-CH=CH2 → C4H9-CH2-CH=CH-CH2Li
Butyllithium lze použít i k polymerizaci ethenu a isoprenu.
Výroba
Ročně se vyrobí asi 1 800 tun butyllithia.[zdroj?]
Obecná výroba organokovových sloučenin lithia probíhá dle rovnice:
RX + 2Li → LiR + LiX
Kdy alkylhalogen reaguje s atomárním lithiem, které se oxiduje za vzniku organokovové sloučeniny a soli. V případě butyllithia se pak k přípravě používá primárně 1-butylbromid. Výsledkem reakce je butyllithium a bromid lithný. Reakce probíhá dle následující rovnice:
BuBr + 2Li → LiBu + LiBr
Příprava
Butyllithium se nejčastěji připravuje reakcí 1-brombutanu nebo 1-chlorbutanu s lithiem:
2 Li + C4H9X → C4H9Li + LiX, kde X je Cl nebo Br.
Lithium používané v této reakci obsahuje 1 % až 3 % sodíku. Roztoky používané v této reakci obsahují benzen, cyklohexan a diethylether.
Pokud je prekurzorem brombutan, produkt je homogenní roztok butyllithia a bromidu lithného s malým množstvím oktanu. V případě použití chlorbutanu jako prekurzoru vzniká směs butyllithia a chloridu lithného.
Bezpečnost
Alkyly lithia se skladují v atmosféře inertního plynu, aby nedošlo ke snížení reaktivity, protože reagují s vodou:
C4H9Li + H2O → C4H10 + LiOH
a s oxidem uhličitým:
C4H9Li + CO2 → C4H9CO2Li.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku n-Butyllithium na anglické Wikipedii.
- ↑ a b Butyllithium. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Butyllithium na Wikimedia Commons
Obrázky, zvuky či videa k tématu Butyllithium na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Ball-and-stick model of the hexamer of butyllithium, (C4H9Li)6.
X-ray crystallographic data from T. Kottke, D. Stalke (September 1993). "Structures of Classical Reagents in Chemical Synthesis: (nBuLi)6, (tBuLi)4, and the Metastable (tBuLi · Et2O)2". Angew. Chem., Int. Ed. Engl. 32 (4): 580-582. DOI:10.1002/anie.199305801.Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances






