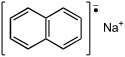
Naftalenid sodný
| Naftalenid sodný | |
|---|---|
 Strukturní vzorec | |
| Obecné | |
| Systematický název | naftalen-1-id sodný |
| Sumární vzorec | C10H8Na |
| Identifikace | |
| Registrační číslo CAS | 3481-12-7 |
| EC-no (EINECS/ELINCS/NLP) | 222-460-3 |
| PubChem | 11829632 |
| SMILES | c1ccc2=C[CH][CH-]C=c2c1.[Na+] |
| InChI | 1S/C10H8.Na/c1-2-6-10-8-4-3-7-9(10)5-1;/h1-8H;/q-1;+1 |
| Vlastnosti | |
| Molární hmotnost | 151,16 g/mol |
Některá data mohou pocházet z datové položky. | |
Naftalenid sodný je organická sloučenina se vzorcem Na+C10H −
8 . Používá se v laboratořích jako redukční činidlo. Při pokusech o izolaci krystaluje v solvatované podobě ligandů vázaných na Na+.[1]
Příprava a vlastnosti

Naftalenidy alkalických kovů se připravují mícháním kovů s naftalenem v etherových rozpouštědlech, jako jsou tetrahydrofuran a dimethoxyethan. Vzniklé soli jsou zbarveny tmavě zeleně.[2]
Anion je radikálový; v EPR vykazuje silný signál poblíž g = 2,0. Zelené zbarvení způsobují absorpce na 463 a 735 nm.
Rentgenovou krystalografií bylo zkoumáno několik solvátů naftalenidu sodného. Vnější pár vazeb CH−CH je zkrácen o 3 pm a zbylých devět vazeb C−C je o 2–3 pm delších; redukce vazby oslabuje.[3][4]
Reakce
Redoxní
S redoxním potenciálem přibližně −2,5 V (oproti standardní vodíkové elektrodě) je naftalenidový radikálový anion silným redukčním činidlem.[1]
Protonace
Tento anion je silně zásaditý a reaguje se zdroji protonů, jako jsou voda a alkoholy, za vzniku dihydronaftalenu:
- 2 NaC10H8 + 2 H2O → C10H10 + C10H8 + 2 NaOH
Jako ligand
Naftalenidy alkalických kovů se používají na přípravu komplexů naftalenu.[5]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Sodium naphthalene na anglické Wikipedii.
- ↑ a b Neil G. Connelly; William E. Geiger. Chemical Redox Agents for Organometallic Chemistry. Chemical Reviews. 1996, s. 877–910. DOI 10.1021/cr940053x. PMID 11848774.
- ↑ E. J. Corey; Andrew W. Gross. tert-Butyl-tert-octylamine. Organic Syntheses. 1987, s. 166. DOI 10.15227/orgsyn.065.0166.
- ↑ Hans Bock; Claudia Arad; Christian Näther; Zdeněk Havlas. The Structures of Solvent-Separated Naphthalene and Anthracene Radical Anions. Journal of the Chemical Society, Chemical Communications. 1995, s. 2393–2394. DOI 10.1039/C39950002393.
- ↑ Maximiliano Castillo; Alejandro J. Metta-Magaña; Skye Fortier. Isolation of Gravimetrically Quantifiable Alkali Metal Arenides Using 18-Crown-6. New Journal of Chemistry. 2016, s. 1923–1926. DOI 10.1039/C5NJ02841H.
- ↑ John E. Ellis. The Chatt Reaction: Conventional Routes to homoleptic Arenemetalates of d-Block Elements. Dalton Transactions. 2019, s. 9538–9563. DOI 10.1039/C8DT05029E. PMID 30724934.
Literatura
- Ting, Li Chu; Joseph V. Friel. Reducing Action of Sodium Naphthalide in Tetrahydrofuran Solution. I. The Reduction of Cobalt(II) Chloride. Journal of the American Chemical Society. 1955, s. 5838–5840. DOI 10.1021/ja01627a017. (anglicky)
- Ting, Li Chu; YU, SHAN CHI. The Magnetic Susceptibilities of Some Aromatic Hydrocarbon Anions. Journal of the American Chemical Society. 1954, s. 3367–3369. DOI 10.1021/ja01642a004. (anglicky)
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Naftalenid sodný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Naftalenid sodný na Wikimedia Commons
Média použitá na této stránce
Autor: LHcheM, Licence: CC BY-SA 3.0
Lithium Naphthalenide in tetrahydrofuran viewed through light
Sodium naphthalenide