Negišiovo párování
Negišiovo párování je organická reakce, druh křížového párování. Používají se při ní organické halogenidy nebo trifláty, které reagují s organozinkovými sloučeninami za tvorby vazeb uhlík–uhlík. Katalyzátory jsou obvykle založeny na Pd0, lze však také použít nikl.[1][2] Katalyzátory založené na niklu mohou obsahovat Ni0 i NiII; jako příklady mohou být uvedeny Ni(PPh3)4, Ni(acac)2 a Ni(COD)2.[3][4][5]
- Odstupující skupinou X je obvykle chlorid, bromid nebo jodid, i když může jít také o triflátovou nebo acetyloxy skupinu. Pokud X = Cl, tak reakce zpravidla probíhají pomalu.
- Organický zbytek R = alkenyl, aryl, allyl, alkynyl nebo propargyl.
- Halogenem X' v organozinkové sloučenině může být chlor, brom či jod a organickým zbytkem R' alkenyl, aryl, allyl, alkyl, benzyl či homoallyl, případně homopropargyl.
- Kov M v katalyzátoru je nikl nebo palladium
- Ligand L v molekule katalyzátoru může být trifenylfosfin, dppe, BINAP nebo chiraphos
Palladiové katalyzátory mívají oproti niklovým vyšší výtěžnosti a lze s nimi použít více různých funkčních skupin.
Negišiova párování jsou častými součástmi totálních syntéz, kde umožňuje selektivní tvorbu vazeb C-C mezi složitými syntetickými meziprodukty. Touto reakcí lze provést párování sp3, sp2 a sp uhlíků, což je u párování katalyzovaných palladiem neobvyklé. Organozinkové sloučeniny jsou citlivé na vlhkost a vzduch, takže se Negišiovy reakce musí provádět za nepřítomnosti kyslíku a vody, což omezuje jejich využití oproti jiným reakcím (například Suzukiově). Organické sloučeniny zinku mají ovšem vyšší reaktivitu než organostannany a organoborany, reakční časy jsou tak kratší.
Tuto reakci objevil Eiči Negiši, který získal v roce 2010 Nobelovu cenu za chemii za její objev a rozpracování.
Negiši se svými spolupracovníky původně zkoumal párování organohlinitých sloučenin, kde jako katalyzátory sloužily nikl a palladium, zjistil že nikl způsobuje zánik stereospecifity, zatímco palladium nikoliv.[6] Po výměně organohlinitých reaktantů za organozinkové byly popsány reakce katalyzované komplexy Pd, což vedlo k dosud používaným reakčním podmínkám.[7]
Mechanismus
Mechanismus Negišiovy párovací reakce začíná oxidací Pd0 na PdII oxidační adiční reakcí s organohalogenidem.[8] Do tohoto kroku je možné zapojit aryl-, vinyl-, alkynyl- a acylhalogenidy, acetáty i trifláty, přičemž rychlost reakce klesá v řadě I > OTf > Br >> Cl.[9]

Přesná podoba mechanismu není známa, jsou zde však dvě pravděpodobné možnosti. Jedna z nich vede přes mechanismus podobný SN2 reakci způsobující obrácení stereochemie. Druhý mechanismus je soustředěný a stereochemii zachovává.

I když jde o cis-adice, tak se palladnatý komplex rychle izomerizuje na trans-komplex.[10]

Následuje transmetalace, kdy organozinečnatá sloučenina zamění organický substituent v palladnatém komplexu za halogenid, čímž se vytvoří trans-palladnatý komplex a halogenid zinku. Organozinkové substráty mohou obsahovat arylové, vinylové, allylové, benzylové, homoallylové i homopropargylové.[8] Transmetalace je obvykle krokem určujícím rychlost reakce; tato část není mechanisticky zcela pochopena , i když byly provedeny studie na toto téma. Bylo zjištěno, že alkylzinkové sloučeniny musí před transmetalací vytvoří zinečnatany, zatímco arylzinky nikoliv.[11] Jako reaktivní činidla lze použít ZnXR i ZnR2, zinek upřednostňuje čtyřkoordinované komplexy, takže komplexy, kde je rozpouštědlo koordinováno na Zn, jako je ZnXR(rozpouštědlo)2 nelze vyloučit.[12] Studie naznačují, že se vytváří rovnováha mezi cis- a trans-bisalkylpalladiovými komplexy, ovšem jediným produktivním meziproduktem je cis.komplex.[13][14]

Posledním krokem katalytického cyklu Negišiova párování je redukční eliminace, která pravděpodobně zahrnuje trojkoordinovaný přechodný stav a vede ke konečnému produktu a obnově katalyzátoru. Pro průběh tohoto kroku je nutné, aby se předtím vytvořil cis-alkylpalladnatý komplex.[15]

Jako výchozí materiál lze použít organozinečnaté halogenidy i diorganozinkové sloučeniny. U první z těchto skupin transmetalacemi vznikají cis-adukty typu R-Pd-R', což vede k rychlé redukční eliminaci, zatímco u druhé trans-adukty musejí nejprve projít pomalou trans-cis izomerizací.[13]
Častou vedlejší reakcí je homopárování. V jednom modelovém systému bylo způsobováno transmetalací mezi diarylkovovým meziproduktem a arylkovovým halogenidem:[16]
- Ar–Pd–Ar' + Ar'–Zn–X → Ar'–Pd–Ar' + Ar–Zn–X
- Ar'–Pd–Ar' → Ar'–Ar' + Pd0 (homopárování)
- Ar–Zn–X + H2O → Ar–H + HO–Zn–X (reakce probíhající společně s dehalogenací)
- Ar'–Pd–Ar' → Ar'–Ar' + Pd0 (homopárování)
Systémy katalyzované niklem mohou fungovat na základě jiných mechanismuů. Na rozdíl od palladia, které se vyskytuje pouze jako Pd0 nebo PdII, obsahují systémy založené na niklu, kov ve více různých oxidačních číslech.[17] Základní kroky jsou v obou případech podobné: oxidační adice, transmetalace a redukční eliminace. U obou systému se také vyskytují rušivé β-hydridové eliminace a oxidační adice alkylových elektrofilů jsou obtížné.[18]
U neaktivovaných alkylových elektrofilů je jedním z možných mechanismů ten, který začíná transmetalací. Alkylzinková sloučenina zde nejprve vyvolá transmetalační reakci s niklovým katalyzátorem, po níž nikl odštěpí halogen z alkylhalogenidu za tvorby alkylového radikálu a oxidace niklu po navázání tohoto radikálu.[19]

Důležitým faktorem pro úplnost popisu mechanismu křížových párování katalyzovaných niklem je to, že redukční eliminace je snadná u niklitých sloučenin, avšak obtížná u nikelnatých, což bylo dokázáno izolací nikelnatého komplexu Ni(PEt3)2(Me)(o-tolyl), u kterého nebyla redukční eliminace dostatečně rychlá na to, aby tato sloučenina prošla příslušným reakčním krokem.[20]
Rozsah
Negišiovo párování bylo použito na následující syntézy:
- nesymetrických 2,2'-bipyridinů z 2-brompyridinu za katalýzy tetrakis(trifenylfosfin)palladiem,[21]
- bifenylu z o-tolylchloridu zinečnatého a o-jodotoluenu za katalýzy tetrakis(trifenylfosfin)palladiem,[22]
- hexadeka-5,7-dienu z dec-1-ynu a (Z)-1-hexenyljodidu.[23]

Na jeho přípravu byla použita Negišiova párovací reakce:[24]
hexajodbenzenu, diferrocenylzinku a tris(dibenzylidenaceton)dipalladia (jako katalyzátoru) v tetrahydrofuranu. Dosažená výtěžnost činila pouze 4 %, což naznačuje výrazné rušivé vlivy okolo arylového jádra.
U novější obdoby bylo nejprve palladium oxidováno halogenketonem (šlo o 2-chlor-2-fenylacetofenon) 1 a vzniklý komplex OPdCl poté mohl reagovat jak s organozinkovou 2, tak i s organocínovou sloučeninou 3 v dvojité transmetalaci:[25]
Podmínky využívané v současnosti poskytují velmi široký rozsah použitelných funkčních skupin a heteroaromatických jader a probíhají při pokojové teplotě nebo v její blízkosti.[26]
Jako příklady Negišiových reakcí katalyzovaných niklem lze uvést sp2-sp2, sp2-sp3 a sp3-sp3 systémy. V prvním zkoumaném případě šlo o křížové párování arylu s arylemm kde jako katalyzátor sloužil Ni(PPh3)4 vytvářený redukcí Ni(acac)2 pomocí PPh3 a (i-Bu)2AlH.[27]

Byly také vyvinuty varianty umožňující párování arylů s alkenyly. V jedné z nich, kterou vyvinuli Paul Knochel et al, reagovaly arylzinečnaté bromidy s vinyltrifláty a vinylhalogenidy.[28]

Reakce typu sp3-sp3 jsou často obtížné; přidáním nenasycených ligandů se skupinami odtahujícími elektrony, sloužícími jako kokatalyzátory, lze výtěžnosti zlepšit. Předpokládá se, že přidání koordinace na nenasycený ligand způsobí převahu redukční eliminace nad β-hydridovou eliminací.[29][30] Tento postup lze použít i u některých alkyl-arylových systémů.[31]
Je popsáno i několik asymetrických variant; v řadě z nich se používají Pyboxové ligandy.[32][33][34]
Průmyslová využití
Negišiho párování se v průmyslu nevyužívá tak často jako Suzukiova a Heckova reakce, protože potřebné organozinkové sloučeniny jsou citlivé vůči vzduchu a vodě.[35][36] V roce 2003 bylo Negišiovo párování použito při výrobě PDE472, inhibitoru fosfodiesterázy 4D, používaného na léčbu astmatu.[37] Negišiovo párování je alternativou k Suzukiově reakci, poskytuje lepší výtěžnost benzodioxazolového meziproduktu, která při použití 4,5 kg reaktantů činí 73 %.[38]
V totálních syntézách
I když se Negišiovo párování, v důsledku citlivosti na vodu a vzduch, v průmyslu používá málo, tak má využití při totálních syntézách přírodních látek. Vyšší reaktivita oproti ostatním křížovým párováním mu dává vhodnost pro spojování složitých meziproduktů.[8] Zinek je také ve srovnání s ostatními kovy, jako je cín používaný ve Stilleově reakci, šetrnější k životnímu prostředí. Negišiovo párování nebylo používáno tak často jako Stilleoco či Suzukiovo, získalo však významná využití v organické syntéze.[39] Jeho výraznou nevýhodou je kromě citlivosti na vodu a vzduch také užší spektrum použitelných funkčních skupin v porovnání s jinými křížovými párováními.[40]
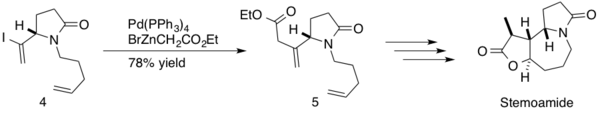
(−)-stemoamid je látka vyskytující se v extraktech z kořenů stemony hlíznaté (‘’Stemona tuberosa’’) Používá se v čínském a japonském lidovém léčitelství na léčbu nemocí dýchací soustavy, také funguje jako anthelmintikum. Do jeho syntézy byla zahrnuta Negišiova párovací reakce.[41] Během této reakce se tvořila sp3-sp2 vazba C-C mezi β,γ-nenasyceným esterem a dienem 4 za vzniku produktu 5 se 78% výtěžností. Stereoselektivní totální syntéza (−)-stemoamidu byla provedena v 1 krocích s celkovou výtěžností 20 %.
Negišiovo párování bylo rovněž zahrnuto do totální syntézy pumiliotoxinu B, jedu obsaženého v žabách rodu Dendrobates. Pumiliotoxiny narušují činnost vápníkových kanálů,xož vede k poruchám činnosti svalů.[42] V závěrečné části syntézy pumiliotoxinu B bylo použito párování homoallylového sp3 uhlíku na zinečnatém alkylidenindolizidinu 6 s E-vinyljodidem 7 s 51% výtěžností. Po odstranění chránicí skupiny byl získán konečný produkt.[43]
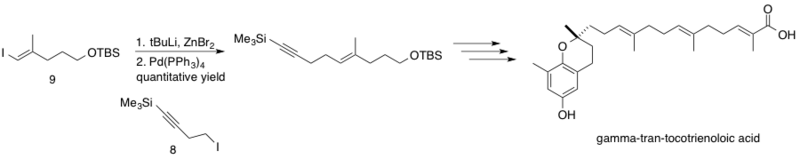
Kyselina δ-trans-tokotrienolová, izolovaná z rostliny Chrysochlamys ulei působí jako inhibitor DNA polymerázy β (pol β), opravující DNA odštěpováním bází. Její inhibice zvyšuje cytotoxicitu , což vede k nižším účinným dávkám cytostatik. Negišiho párování zde spojuje sp3 homopropargylový zinkový reaktant 8 s sp2 vinyljodidem 9.[44] Reakce probíhá kvantitativně.
Sean W. Smith a Gregory C. Fu použili tento postup k párování sekundárních nukleofilů se sekundárními alkylovými elektrofily k syntéze α-cembra-2,7,11-trien-4,6-diolu, sloučeniny vykazující protinádorovou aktivitu. Dosáhli přitom s použitím gramových množství reaktantů 61% výtěžnosti při navazování isopropylové skupiny. Uvedený postup lze použít di k zavádění dalších alkylových skupin.[45]

Použití Negiošova párování katalyzovaného niklem při totální syntéze karolaktonu; výtěžnost dosáhla 82 .[46]

Příprava organozinkových prekurzorů
Alkylzinková činidla lze získat reakcemi příslušných alkylbromidů s jodem v dimethylacetamidu (DMAC).[47] Jod zde aktivuje zinek vůči nukleofilní adici.
Arylzinkové sloučeniny se dají připravit za mírných podmínek přes meziprodukty podobné Grignardovým činidlům.[48]
Organické sloučeniny zinku mohou být tvořeny na místě a zapojeny do jednonádobových syntéz.[49]

Odkazy
Reference
V tomto článku byl použit překlad textu z článku Negishi coupling na anglické Wikipedii.
- ↑ KING, Anthony O.; OKUKADO, Nobuhisa; NEGISHI, Ei-ichi. Highly general stereo-, regio-, and chemo-selective synthesis of terminal and internal conjugated enynes by the Pd-catalysed reaction of alkynylzinc reagents with alkenyl halides. Journal of the Chemical Society, Chemical Communications. 1977, s. 683. DOI 10.1039/C39770000683. (anglicky)
- ↑ KÜRTI, László; CZAKÓ, Barbara. Strategic applications of named reactions in organic synthesis : background and detailed mechanisms ; 250 named reactions. Amsterdam: Elsevier Academic Press, 2007. ISBN 978-0-12-429785-2. (anglicky)
- ↑ ZHOU, Jianrong (Steve); FU, Gregory C. Cross-Couplings of Unactivated Secondary Alkyl Halides: Room-Temperature Nickel-Catalyzed Negishi Reactions of Alkyl Bromides and Iodides. Journal of the American Chemical Society. December 2003, s. 14726–14727. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja0389366. PMID 14640646. (anglicky)
- ↑ NEGISHI, Eiichi; KING, Anthony O.; OKUKADO, Nobuhisa. Selective carbon-carbon bond formation via transition metal catalysis. 3. A highly selective synthesis of unsymmetrical biaryls and diarylmethanes by the nickel- or palladium-catalyzed reaction of aryl- and benzylzinc derivatives with aryl halides. The Journal of Organic Chemistry. 1977-05-01, s. 1821–1823. Dostupné online. ISSN 0022-3263. DOI 10.1021/jo00430a041. (anglicky)
- ↑ GAVRYUSHIN, Andrei; KOFINK, Christiane; MANOLIKAKES, Georg; KNOCHEL, Paul. Efficient Cross-Coupling of Functionalized Arylzinc Halides Catalyzed by a Nickel Chloride−Diethyl Phosphite System. Organic Letters. 2005-10-01, s. 4871–4874. Dostupné online. ISSN 1523-7060. DOI 10.1021/ol051615+. PMID 16235910. (anglicky)
- ↑ Baba S, Negishi E. A novel stereospecific alkenyl-alkenyl cross-coupling by a palladium- or nickel-catalyzed reaction of alkenylalanes with alkenyl halides. Journal of the American Chemical Society. 1976, s. 6729–6731. DOI 10.1021/ja00437a067. (anglicky)
- ↑ Negishi E., King A. O., Okukado N. Selective carbon-carbon bond formation via transition metal catalysis. 3. A highly selective synthesis of unsymmetrical biaryls and diarylmethanes by the nickel- or palladium-catalyzed reaction of aryl- and benzylzinc derivatives with aryl halides. The Journal of Organic Chemistry. 1977, s. 1821–1823. DOI 10.1021/jo00430a041. (anglicky)
- ↑ a b c Kurti L, Czako B. Strategic Applications of Named Reactions in Organic Synthesis. New York: Elsevier Academic Press, 2005. (anglicky)
- ↑ Andrew G Myers Research Group. Chemistry 115 Handouts [online]. Boston: Harvard University Department of Chemistry [cit. 2021-11-02]. Dostupné v archivu pořízeném dne 2019-03-29. (anglicky)
- ↑ Casado AL, Espinet P. On the Configuration Resulting from Oxidative Addition of RX to Pd(PPh3)4 and the Mechanism of the cis-to-trans Isomerization of [PdRX(PPh3)2] Complexes (R = Aryl, X = Halide). Organometallics. 1998, s. 954–959. DOI 10.1021/om9709502. (anglicky)
- ↑ McCann LC, Hunter HN, Clyburne JA, Organ MG. Higher-order zincates as transmetalators in alkyl-alkyl negishi cross-coupling. Angewandte Chemie. July 2012, s. 7024–7. DOI 10.1002/anie.201203547. PMID 22685029. (anglicky)
- ↑ García-Melchor M., Braga A. A., Lledós A., Ujaque G., Maseras F. Computational perspective on Pd-catalyzed C-C cross-coupling reaction mechanisms. Accounts of Chemical Research. November 2013, s. 2626–34. DOI 10.1021/ar400080r. PMID 23848308. (anglicky)
- ↑ a b Casares J. A., Espinet P., Fuentes B., Salas G. Insights into the mechanism of the Negishi reaction: ZnRX versus ZnR2 reagents. Journal of the American Chemical Society. March 2007, s. 3508–9. DOI 10.1021/ja070235b. PMID 17328551. (anglicky)
- ↑ Fuentes B., García-Melchor M., Lledós A., Maseras F., Casares J. A., Ujaque G., Espinet P. Palladium round trip in the Negishi coupling of trans-[PdMeCl(PMePh2)2] with ZnMeCl: an experimental and DFT study of the transmetalation step. Chemistry. August 2010, s. 8596–9. DOI 10.1002/chem.201001332. PMID 20623568. (anglicky)
- ↑ Crabtree R. The Organometallic Chemistry of the Transition Metals. Hoboken, NJ: John Wiley and Sons Inc., 2005. (anglicky)
- ↑ Liu Q, Lan Y, Liu J, Li G, Wu Y. D., Lei A. Revealing a second transmetalation step in the Negishi coupling and its competition with reductive elimination: improvement in the interpretation of the mechanism of biaryl syntheses. Journal of the American Chemical Society. July 2009, s. 10201–10. DOI 10.1021/ja903277d. PMID 19572717. (anglicky)
- ↑ PHAPALE, Vilas B.; CÁRDENAS, Diego J. Nickel-catalysed Negishi cross-coupling reactions: scope and mechanisms. Chemical Society Reviews. 2009-05-27, s. 1598–1607. Dostupné online. ISSN 1460-4744. DOI 10.1039/B805648J. PMID 19587955. (anglicky)
- ↑ ZHOU, Jianrong (Steve); FU, Gregory C. Cross-Couplings of Unactivated Secondary Alkyl Halides: Room-Temperature Nickel-Catalyzed Negishi Reactions of Alkyl Bromides and Iodides. Journal of the American Chemical Society. December 2003, s. 14726–14727. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja0389366. PMID 14640646. (anglicky)
- ↑ SCHLEY, Nathan D.; FU, Gregory C. Nickel-Catalyzed Negishi Arylations of Propargylic Bromides: A Mechanistic Investigation. Journal of the American Chemical Society. 2014-11-26, s. 16588–16593. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja508718m. PMID 25402209. (anglicky)
- ↑ MORRELL, Dennis G.; KOCHI, Jay K. Mechanistic studies of nickel catalysis in the cross coupling of aryl halides with alkylmetals. Role of arylalkylnickel(II) species as intermediates. Journal of the American Chemical Society. 1975-12-01, s. 7262–7270. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja00858a011. (anglicky)
- ↑ ADAM P. SMITH, SCOTT A. SAVAGE, J. CHRISTOPHER LOVE, AND CASSANDRA L. FRASER. Synthesis of 4-, 5-, and 6-methyl-2,2'-bipyridine by a Negishi cross-coupling strategy: 5-methyl-2,2'-bipyridine. Org. Synth.. 2004. Dostupné online. (anglicky); Coll. Vol.. S. 517. (anglicky)
- ↑ EI-ICHI NEGISHI, TAMOTSU TAKAHASHI AND ANTHONY O. KING. Synthesis of biaryls via palladium-catalyzed cross-coupling: 2-methyl-4'-nitrobiphenyl. Org. Synth.. 1993. Dostupné online. (anglicky); Coll. Vol.. S. 430. (anglicky)
- ↑ EI-ICHI NEGISHI, TAMOTSU TAKAHASHI, AND SHIGERU BABA. Palladium-catalyzed synthesis of conjugated dienes. Org. Synth.. 1993. Dostupné online. (anglicky); Coll. Vol.. S. 295. (anglicky)
- ↑ Yu Y., Bond A. D., Leonard P. W., Lorenz U. J., Timofeeva T. V., Vollhardt K. P., Whitener G. D., Yakovenko A. A. Hexaferrocenylbenzene. Chemical Communications. June 2006, s. 2572–4. Dostupné online. DOI 10.1039/b604844g. PMID 16779481. (anglicky)
- ↑ Zhao Y., Wang H., Hou X., Hu Y., Lei A., Zhang H., Zhu L. Oxidative cross-coupling through double transmetallation: surprisingly high selectivity for palladium-catalyzed cross-coupling of alkylzinc and alkynylstannanes. Journal of the American Chemical Society. November 2006, s. 15048–9. DOI 10.1021/ja0647351. PMID 17117830. (anglicky)
- ↑ Yang Y., Oldenhuis N. J., Buchwald S. L. Mild and general conditions for negishi cross-coupling enabled by the use of palladacycle precatalysts. Angewandte Chemie. January 2013, s. 615–9. DOI 10.1002/anie.201207750. PMID 23172689. (anglicky)
- ↑ NEGISHI, Eiichi; KING, Anthony O.; OKUKADO, Nobuhisa. Selective carbon-carbon bond formation via transition metal catalysis. 3. A highly selective synthesis of unsymmetrical biaryls and diarylmethanes by the nickel- or palladium-catalyzed reaction of aryl- and benzylzinc derivatives with aryl halides. The Journal of Organic Chemistry. 1977-05-01, s. 1821–1823. Dostupné online. ISSN 0022-3263. DOI 10.1021/jo00430a041. (anglicky)
- ↑ GAVRYUSHIN, Andrei; KOFINK, Christiane; MANOLIKAKES, Georg; KNOCHEL, Paul. Efficient Cross-Coupling of Functionalized Arylzinc Halides Catalyzed by a Nickel Chloride−Diethyl Phosphite System. Organic Letters. 2005-10-01, s. 4871–4874. Dostupné online. ISSN 1523-7060. DOI 10.1021/ol051615+. PMID 16235910. (anglicky)
- ↑ GIOVANNINI, Riccardo; STÜDEMANN, Thomas; DUSSIN, Gaelle; KNOCHEL, Paul. An Efficient Nickel-Catalyzed Cross-Coupling Between sp3 Carbon Centers. Angewandte Chemie International Edition. 1998, s. 2387–2390. Dostupné online. ISSN 1521-3773. DOI 10.1002/(SICI)1521-3773(19980918)37:17<2387::AID-ANIE2387>3.0.CO;2-M. PMID 29710957. (anglicky)
- ↑ JENSEN, Anne Eeg; KNOCHEL, Paul. Nickel-Catalyzed Cross-Coupling between Functionalized Primary or Secondary Alkylzinc Halides and Primary Alkyl Halides. The Journal of Organic Chemistry. 2002-01-01, s. 79–85. Dostupné online. ISSN 0022-3263. DOI 10.1021/jo0105787. PMID 11777442. (anglicky)
- ↑ GIOVANNINI, Riccardo; KNOCHEL, Paul. Ni(II)-Catalyzed Cross-Coupling between Polyfunctional Arylzinc Derivatives and Primary Alkyl Iodides. Journal of the American Chemical Society. 1998-11-01, s. 11186–11187. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja982520o. (anglicky)
- ↑ FISCHER, Christian; FU, Gregory C. Asymmetric Nickel-Catalyzed Negishi Cross-Couplings of Secondary α-Bromo Amides with Organozinc Reagents. Journal of the American Chemical Society. April 2005, s. 4594–4595. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja0506509. PMID 15796523. (anglicky)
- ↑ SON, Sunghee; FU, Gregory C. Nickel-Catalyzed Asymmetric Negishi Cross-Couplings of Secondary Allylic Chlorides with Alkylzincs. Journal of the American Chemical Society. 2008-03-01, s. 2756–2757. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja800103z. PMID 18257579. (anglicky)
- ↑ PHAPALE, Vilas B.; BUÑUEL, Elena; GARCÍA-IGLESIAS, Miguel; CÁRDENAS, Diego J. Ni-Catalyzed Cascade Formation of C(sp3)–C(sp3) Bonds by Cyclization and Cross-Coupling Reactions of Iodoalkanes with Alkyl Zinc Halides. Angewandte Chemie International Edition. 2007, s. 8790–8795. Dostupné online. ISSN 1521-3773. DOI 10.1002/anie.200702528. PMID 17918274. (anglicky)
- ↑ Johansson Seechurn C. C., Kitching M. O., Colacot T. J., Snieckus V. Palladium-catalyzed cross-coupling: a historical contextual perspective to the 2010 Nobel Prize. Angewandte Chemie. May 2012, s. 5062–85. DOI 10.1002/anie.201107017. PMID 22573393. (anglicky)
- ↑ Sase S., Jaric M., Metzger A., Malakhov V., Knochel P. One-pot Negishi cross-coupling reactions of in situ generated zinc reagents with aryl chlorides, bromides, and triflates. The Journal of Organic Chemistry. September 2008, s. 7380–2. DOI 10.1021/jo801063c. PMID 18693766. (anglicky)
- ↑ Manley PW, Acemoglu M, Marterer W, Pachinger W. Large-Scale Negishi Coupling as Applied to the Synthesis of PDE472, an Inhibitor of Phosphodiesterase Type 4D. Organic Process Research & Development. 2003, s. 436–445. DOI 10.1021/op025615q. (anglicky)
- ↑ Torborg C, Beller M. Recent Applications of Palladium-Catalyzed Coupling Reactions in the Pharmaceutical, Agrochemical, and Fine Chemical Industries. Advanced Synthesis & Catalysis. 2009, s. 3027–3043. DOI 10.1002/adsc.200900587. (anglicky)
- ↑ Nicolaou K. C., Bulger P. G., Sarlah D. Palladium-catalyzed cross-coupling reactions in total synthesis. Angewandte Chemie. July 2005, s. 4442–89. DOI 10.1002/anie.200500368. PMID 15991198. (anglicky)
- ↑ Lessene G. Advances in the Negishi coupling. Australian Journal of Chemistry. 2004, s. 107. DOI 10.1071/ch03225. (anglicky)
- ↑ Torssell S., Wanngren E., Somfai P. Total synthesis of (-)-stemoamide. The Journal of Organic Chemistry. May 2007, s. 4246–9. DOI 10.1021/jo070498o. PMID 17451274. (anglicky)
- ↑ Gusovsky F., Padgett W. L., Creveling C. R., Daly J. W. Interaction of pumiliotoxin B with an "alkaloid-binding domain" on the voltage-dependent sodium channel. Molecular Pharmacology. December 1992, s. 1104–8. PMID 1336116. (anglicky)
- ↑ Aoyagi S., Hirashima S., Saito K., Kibayashi C. Convergent Approach to Pumiliotoxin Alkaloids. Asymmetric Total Synthesis of (+)-Pumiliotoxins A, B, and 225F. The Journal of Organic Chemistry. 2002, s. 5517–5526. DOI 10.1021/jo0200466. PMID 12153249. (anglicky)
- ↑ Maloney DJ, Hecht SM. A stereocontrolled synthesis of delta-trans-tocotrienoloic acid. Organic Letters. September 2005, s. 4297–300. DOI 10.1021/ol051849t. PMID 16146411. (anglicky)
- ↑ SMITH, Sean W.; FU, Gregory C. Nickel-Catalyzed Negishi Cross-Couplings of Secondary Nucleophiles with Secondary Propargylic Electrophiles at Room Temperature. Angewandte Chemie International Edition. 2008, s. 9334–9336. Dostupné online. ISSN 1521-3773. DOI 10.1002/anie.200802784. PMID 18972493. (anglicky)
- ↑ SCHMIDT, Thomas; KIRSCHNING, Andreas. Total Synthesis of Carolacton, a Highly Potent Biofilm Inhibitor. Angewandte Chemie International Edition. 2012, s. 1063–1066. Dostupné online. ISSN 1521-3773. DOI 10.1002/anie.201106762. PMID 22162345. (anglicky)
- ↑ Huo S. Highly efficient, general procedure for the preparation of alkylzinc reagents from unactivated alkyl bromides and chlorides. Organic Letters. February 2003, s. 423–5. DOI 10.1021/ol0272693. PMID 12583734. (anglicky)
- ↑ Giovannini R., Knochel P. Ni(II)-Catalyzed Cross-Coupling between Polyfunctional Arylzinc Derivatives and Primary Alkyl Iodides. Journal of the American Chemical Society. 1998, s. 11186–11187. DOI 10.1021/ja982520o. (anglicky)
- ↑ SASE, Shohei; JARIC, Milica; METZGER, Albrecht; MALAKHOV, Vladimir; KNOCHEL, Paul. One-Pot Negishi Cross-Coupling Reactions of In Situ Generated Zinc Reagents with Aryl Chlorides, Bromides, and Triflates. The Journal of Organic Chemistry. 2008-09-19, s. 7380–7382. Dostupné online. ISSN 0022-3263. DOI 10.1021/jo801063c. PMID 18693766. (anglicky)
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Negišiovo párování na Wikimedia Commons
Obrázky, zvuky či videa k tématu Negišiovo párování na Wikimedia Commons - Negišiovo párování na www.organic-chemistry.org
Média použitá na této stránce
(c) V8rik from en.wikipedia.org, CC BY-SA 3.0
Double Transmetallation crosscoupling
Autor: Jakeblack11, Licence: CC BY-SA 4.0
General reaction scheme for Negishi coupling.
Stick model of the hexaferrocenylbenzene molecule, based on the x-ray crystallographic data from Yong Yu, Andrew D. Bond, Philip W. Leonard, Ulrich J. Lorenz, Tatiana V. Timofeeva, K. Peter C. Vollhardt, Glenn D. Whitener and Andrey A. Yakovenko (2006). "Hexaferrocenylbenzene". Chemical Communications: 2572 - 2574. DOI:10.1039/b604844g..