Neuroonkologie

Neuroonkologie je specializace lékařství, která spojuje neurologii a onkologii.
Neuroonkologie se zabývá především diagnostikou, terapií a výzkumem nádorových onemocnění nervového systému, který zahrnuje tyto typy nádorů:
- primární nádory centrálního nervového systému (nádory mozku a nádory míchy)
- sekundární nádory centrálního nervového systému (mozkové a míšní metastázy)
- maligní lymfomy centrálního nervového systému
- nádory periferního nervového systému
Již tento výčet ukazuje, že se jedná o širokou oblast, kterou je obtížné definovat. Zatímco léčba lymfomů centrálního nervového systému se řídí také hematologickou léčbou a mozkové metastázy nejsou léčeny odděleně od základní terapie primárního nádoru, nádory periferních nervů jako neurinomy jsou benigní, a stejně jako jiné nádory měkkých tkání jsou často lokalizovány v ortopedické oblasti.
Obecná informace
Primární nádory centrálního nervového systému
Primární mozkové nádory se mohou objevit v jakémkoli věku, od dětství až po pozdní věk. Faktory, jako je věk, umístění nádoru a klinický obraz, jsou užitečné v diferenciální diagnostice. Většina typů primárních mozkových nádorů je častější u mužů, s výjimkou meningeomů, které jsou častější u žen. Metastatické nádory centrálního nervového systému Přímá invaze nebo komprese souvislých tkání souvisí s blízkostí nervového systému k jiným strukturám.
Intrakraniální metastáza
Existují tři typy intrakraniálních metastáz: mozkové metastázy, durální metastázy a meningeální-leptomeningeální metastázy. Mozkové metastázy mohou být jednotlivé nebo vícečetné a postihují kteroukoli část mozku. K metastázám do durálních struktur obecně dochází hematogenním šířením nebo přímou invazí ze sousední kosti. Durální metastázy mohou napadnout základní mozek a způsobit fokální edém a související neurologické příznaky. Vzhledem ke své kortikální lokalizaci mají tyto procesy tendenci způsobovat záchvaty brzy v průběhu. Leptomeningeální metastáza je vzácný, ale dobře známý klinický jev u pacientů s rakovinou. Leptomeningeální metastázy jsou nejčastěji způsobeny primárními nádory prsu, plic nebo melanomu.
Lebeční metastázy
Metastázy do lebky se dělí do dvou kategorií: Kalvárie a spodina lebky.
Primární nádory centrálního nervového systému
První poddělení nádorů centrálního nervového systému (CNS) se vyskytuje mezi primárními (pocházejícími přímo z CNS) a metastatickými (pocházejícími z jiného orgánu) nádory. Ty druhé mají incidenci přibližně desetkrát vyšší než první. Nádory mozku jsou novotvary, které se vyvíjejí v mozku. Nádory, jako je meningiom, který díky své hmotě stlačuje, ale neproniká do mozku, a nádory hypofýzy a epifýzy, které se nacházejí na mozkovém kmeni, jsou často nesprávně označovány jako nádory mozku. Termín intrakraniální nádory je přesněji shrnuje.
Primární nádory CNS zahrnují různé patologické entity, z nichž každá má svou vlastní přirozenou historii. Vzhledem k tomu, že samotné gliové nádory tvoří téměř 40 procenta těchto nádorů lze nejprve rozlišit mezi gliovými nádory (gliomy) a negliovými nádory. Nejběžnějšími gliomy jsou astrocytomy (pocházející z gliových astrocytových buněk), oligodendrogliomy (pocházející z oligodendrogliových buněk) a ependymomy (pocházející z ependymových buněk).
Epidemiologie
Maligní primární nádory centrálního nervového systému jsou relativně vzácné a tvoří asi 2 procent všech maligních novotvarů. Nádorová onemocnění centrálního nervového systému jsou rozdělena do 95 procenta na mozek a na 5 Procento na mozkových plenách, hlavových nervech a míše. Mohou se vyskytnout v jakémkoli věku a riziko vzniku onemocnění se zvyšuje s věkem. U dospělých lze nalézt gliomy histologicky pocházející z podpůrné tkáně nervových buněk, z nichž asi 75 procent glioblastomů Astrocytomy IV. stupně s nepříznivou prognózou. Embryonální nádory převažují u kojenců a malých dětí. Statistiky také vzácně zahrnují histologicky benigní nádory CNS, které se vyskytují asi u 6000 nové případy per rok lež. Asi 65 Procento pochází z mozkových blan. Ženy jsou postiženy mnohem častěji. Pokud se neléčí chirurgicky nebo radiační terapií, mohou být i benigní nádory smrtelné kvůli progresivnímu růstu v uzavřeném lebečním prostoru. Nejčastějším maligním intrakraniálním nádorem CNS je glioblastom, nejčastějším benigním je meningiom.
Etiologie
Genetická predispozice k novotvarům centrálního nervového systému je relativně vzácná, i když některé gliomy se mohou vyskytnout jako komplikace mnoha rodinných onemocnění. Mutace některých tumor supresorových genů charakterizuje několik dědičných syndromů, které vykazují zvýšenou náchylnost k rozvoji mozkových nádorů. S vyšším rizikem vzniku mozkových nádorů jsou spojeny následující mutace a jejich syndromy: mutace genu NF1 s neurofibromatózou typu 1, mutace APC s Turcotovým syndromem, mutace PTCH s Gorlinovým syndromem a TP53 nebo CHEK2 -mutace s Li-Fraumeni syndromem.
Faktory prostředí spojené s primárními mozkovými nádory je obtížné identifikovat. V některých studiích byla expozice vinylchloridu spojena se zvýšeným výskytem gliomů vysokého stupně. Jedinou vzácnou, ale dobře identifikovanou příčinou primárního mozkového nádoru je ionizující záření. Zejména radiační terapie dětí s tinea capitis a pacientů s akutní lymfatickou leukémií, kraniofaryngiomem nebo non-Hodgkinovým lymfomem je spojena se zvýšeným rizikem gliomu. Pacienti s AIDS mají zvýšené riziko primárního mozkového lymfomu.
Klinika
Příznaky
Příznaky mozkové neoplazie jsou charakterizovány posunem, resp. zničením okolní tkáně a infiltrace ze stejných příčin. Nejčastějším příznakem, který udává 35 procent pacientů, je bolest hlavy. Výskyt silných bolestí hlavy u pacientů, kteří jimi trpí jinak zřídka, je často charakteristický, zvláště pokud jsou záchvaty bolesti hlavy nebo migrény silnější ráno a jsou doprovázeny nevolností, zvracením a neurologickými deficity. U pacientů, kteří častěji trpí bolestmi hlavy, může být změna tvaru, zvýšení frekvence nebo intenzity záchvatů příznakem rozvoje mozkového nádoru. Záchvaty se vyskytují asi u jedné třetiny pacientů s gliomem, zejména u nádorů nízkého stupně nebo CNS. Fokální neurologické deficity souvisí s lokalizací nádoru. Změny duševního stavu se také vyskytují u 15 až 20 procent pacientů s gliomem.
Zobrazovací diagnostika

Počítačová tomografie (CT) a magnetická rezonance (MRI) mohou účinně detekovat neoplazii v mozku. MRI je citlivější než CT pro identifikaci lézí, ale má kontraindikace pro pacienty s kardiostimulátory, nekompatibilními protézami, kovovými svorkami a dalšími. CT zůstává metodou volby k detekci kalcifikací v lézích nebo kostních erozích lebky nebo spodiny. Použití kontrastních látek, které jsou v případě CT jodované a v případě MRI paramagnetické ( gadolinium ), umožňuje získat informace o vaskularizaci a integritě hematoencefalické bariéry, lepší definici nádorového nádoru ve srovnání k okolnímu edému a generování hypotéz o stupni malignity. Radiologické vyšetření také umožňuje posouzení mechanických účinků a následných změn v mozkových strukturách vyplývajících z nádoru, jako je hydrocefalus a kýla, jejichž účinky mohou být fatální. Konečně, v rámci přípravy na operaci, může být tato diagnostika použita k určení umístění léze nebo infiltrace nádoru do životně důležitých oblastí mozku. Pro tento účel je MRI účinnější než CT, protože může poskytovat trojrozměrné obrazy.

Diagnostické radiologické zobrazovací nástroje zdůrazňují změnu neoplastické tkáně ve srovnání s normálním mozkovým parenchymem (prostřednictvím změn v elektronicky zobrazené hustotě tkáně na CT a intenzitě signálu na MRI). Jako většina patologických tkání jsou nádory také rozpoznatelné podle zvýšené akumulace intracelulární vody. Na počítačovém tomogramu se jeví hypodenzní, tj. s menší hustotou než mozkový parenchym, na tomogramu nukleární magnetické rezonance s relaxací spin-mřížky hypointenzivní a při spin-spin relaxaci stejně jako protonové vážení (PD) hyperintenzivní.
Na rentgenovém snímku by oblast zdravého mozku neměla vykazovat žádnou zvláštní luminiscenci. Samozřejmostí je proto věnovat pozornost větším rozsahům kontrastního signálu.
V nádorové tkáni je obecně větší podíl zvýšení kontrastu způsoben konkrétní hematonádorovou bariérou, která umožňuje průchod jódu (CT) a gadolinia (MRI) do intratumorálního extravaskulárního intersticiálního prostoru. To zvyšuje signál (hustotu nebo intenzitu) nádoru. Je však třeba dbát na to, aby zvýšení kontrastu definitivně neodlišilo neoplazii od edému v okolí rány. Ve skutečnosti anatomicko-patologický nález v maligní infiltrující nádorové tkáni gliomu, jako u glioblastomu a anaplastického astrocytomu, se také projevuje mimo vazogenní edém způsobený destrukcí hematoencefalické bariéry nádorem. Poslední klinický stav je špatně detekovatelný diagnostickým zobrazením.
Počítačová tomografie mozku typicky ukazuje tkáňovou hmotu, která může být zesílena oběma kontrasty. Na CT se gliomy nízkého stupně obvykle jeví jako izodenzní s normálním parenchymem, a proto nemusí vykazovat zvýšení kontrastu. Podobně léze v zadní jámě lebeční, zadní jámě lebeční, je obtížné identifikovat na CT. V důsledku toho výsledky takové tomografie samy o sobě nejsou vždy dostatečné pro diagnostické účely. V pochybných případech je nezbytné použití citlivějšího zobrazování magnetickou rezonancí.
Na -MRI ukazuje intrakraniální tumor jako masivní lézi, která se po použití kontrastní látky může stát více luminiscenční. Vždy však dojde k anomálii signálu -Magnetická rezonance, která indikuje přítomnost neoplazie nebo vazogenního edému. Obvykle zvýšená luminiscence (zesílení kontrastu) svědčí pro nádor vyššího stupně malignity. Pro glioblastom je charakteristický kontrastní prstenec, jehož luminiscenční část odpovídá vitální části maligního nádoru a tmavší -hypointense oblast odpovídající nekróze tkáně.
Inscenování
Většina primárních intrakraniálních nádorů zůstává lokalizována v lebce, takže systémové postupy stagingu nejsou nutné.
Naproti tomu primární neuroektodermální tumory, meduloblastomy, tumory zárodečných buněk CNS a primární lymfomy CNS se často šíří přes subarachnoidální prostor do leptomeningů. U všech pacientů s takovými diagnózami je proto také nutná spinální magnetická rezonance nebo lumbální punkce.
Typy nádorů
Gliomy
Primární nádory centrálního nervového systému (CNS) zahrnují různé patologické tkáně, z nichž každá má svou vlastní přirozenou historii. Vzhledem k tomu, že samotné gliomy tvoří téměř 40 procent všech nádorů CNS, je v literatuře běžné rozlišovat mezi gliovými a negliovými nádory.
Astrocytomy
V literatuře byly postupem času navrženy různé systémy kategorií pro klasifikaci malignity astrocytomů. Od roku 1993 je nejrozšířenější a nejpoužívanější čtyřstupňový systém hodnocení navržený Světovou zdravotnickou organizací (WHO). Je založena na čtyřech histologických rysech: zvýšená hustota buněk, mitóza, proliferace endotelu a nekróza. Poté jsou astrocytomy I. stupně, jako jsou pilocytické astrocytomy, typicky benigní histologie. Astrocytomy II. Stupně (difuzní) vykazují zvýšenou hustotu buněk jako jediný histologický znak a jsou to novotvary s nižším stupněm infiltrace. Astrocytomy III vykazují významnou mitózu. třídy (anaplastické). A endoteliální proliferace nebo nekróza jsou pozorovány u astrocytomů IV. stupně, tzv. glioblastomy.
Astrocytomy nízkého stupně

Pilocytární astrocytomy (včetně pilomyxoidního aastrocytomu ), subependymální obrovskobuněčné astrocytomy a pleomorfní xantastrocytomy patří mezi ohraničené nádory. Jde o poněkud vzácnější novotvary benigní histologie, které lze často vyléčit pouze chirurgicky. Pokud je excize neúplná, lze zbývající nádorovou tkáň úspěšně léčit radiační terapií. Ve vzácných případech, kdy lokální léčba nezabírá, může být úspěšná systémová chemoterapie, kterou je nutné individuálně upravit. Děti reagují na kombinaci karboplatiny a vinkristinu.


Na počítačové tomografii se objevují difuzní astrocytomy II. Stupně než méně intenzivní léze. Při preferovaném zobrazování magnetickou rezonancí nemusí kontrastní látky tyto novotvary zvýraznit, jejich luminiscence může být tenčí a slabší. Intenzivnější může indikovat tkáně se zvýšenou anaplazií. Kdykoli je to možné, doporučuje se biopsie k získání vzorků z anaplastické části nádoru.
Ve většině případů jsou pacienti s difuzními astrocytomy ve věku 20 až 40 let. Typický je pro ně výskyt epileptických záchvatů. Podmínky příznivé prognózy jsou nízký věk, velikost tumoru pod 50 milimetrů a co nejrozsáhlejší chirurgická resekce tumoru. Pozdní recidivy jsou poměrně časté, a proto je potřeba pacienty po odstranění nádoru sledovat ještě 15 let.
Navzdory jejich relativně pomalému průběhu většina astrocytomů progreduje do lézí charakterizovaných rozsáhlou anaplazií, které jsou obvykle refrakterní na chirurgii a radiační terapii. Terapie pacientů s difuzními astrocytomy nízkého stupně však v literatuře nevykazuje jednomyslný konsenzus. Role kompletní resekce je diskutována v odborných souvislostech. Výsledky některých studií ukazují, že maximální odstranění nádoru dává nejlepší výsledky. Ve skutečnosti mohou být malé a jednostranné nádory zcela odstraněny, pokud nejsou zapojeny žádné kritické struktury mozku. Pragmatickým přístupem, který je obecně přijatelný pro obecnost případů, je odstranit neoplazii, jak je to jen možné, aby se předešlo významným neurologickým deficitům.
Studie ukázaly, že radiační terapie podaná bezprostředně po diagnóze prodloužila dobu, po kterou je pacient bez onemocnění před recidivou nádoru, ve srovnání se situací, kdy je průběh radiační terapie odložen až do doby progrese. V současnosti však neexistuje shoda, že radiační terapie krátce po diagnóze zlepšuje pacientovo „celkové přežití“.
U pacientů s mírnějšími nebo žádnými příznaky nebo se záchvaty, které lze kontrolovat léky proti záchvatům, je možné odložit radioterapii, dokud růst nádoru nedosáhne kritické fáze. Často existuje potřeba snížit riziko neurologického poškození způsobeného samotnou radiační terapií.
Dvě prospektivní randomizované klinické studie neprokázaly větší přínos vysokodávkové radioterapie než nízkodávkové radioterapie. Typicky je celková dávka mezi 45 a 54 Gray s frakcionací 1,8 až 2 Gray.
Efekt adjuvantní chemoterapie u pacientů s astrocytomy nízkého stupně malignity je stále předmětem zkoumání. Předběžné výsledky z klinické studie porovnávající samotnou radioterapii s radioterapií následovanou chemoterapií obsahující prokarbazin, lomustin a vinkristin (PCV) ukázaly delší dobu „přežití bez onemocnění“ s kombinací, ale neprodloužily „celkové přežití“. Vzhledem k toxicitě související s protokolem PCV se použití temozolomidu doporučuje jako počáteční léčba i po zotavení.
Anaplastické astrocytomy

Anaplastický astrocytom je maligní nádor mozku charakterizovaný difúzním růstem, zvýšenou hustotou buněk a dělením jádra. Vzniká ze specifické buněčné populace centrálního nervového systému, astrocytů. Podle klasifikace WHO nádorů centrálního nervového systému odpovídá nádor nádoru III. stupně.
Typicky se u pacientů s anaplastickým astrocytomem objevují epileptické záchvaty, fokální neurologické deficity, bolesti hlavy a změny osobnosti. Průměrný věk pacientů je 45 let. Magnetická rezonance obecně ukazuje masivní lézi se zvýšeným kontrastním signálem, který může být i slabší. Diagnóza je histologickým vyšetřením léze biopsií nebo chirurgickou resekcí.
Horší prognóza může být spojena s pokročilým věkem, špatnou fyzickou kondicí a významným neurologickým poškozením. Obecně platí, že léčebný výsledek je lepší při kompletní chirurgické resekci (standardní léčbě) bez zvýšení neurologického deficitu. Radiační terapie je standardní, protože bylo prokázáno, že prodlužuje dobu přežití. Role chemoterapie je kontroverzní.
Glioblastomy

Nejčastějšími a maligními nádory z gliových buněk jsou glioblastomy. Skládají se z heterogenní masy špatně diferencovaných buněk astrocytomu hlavně u dospělých. Obvykle se vyskytují v mozkových hemisférách, vzácněji v mozkovém kmeni nebo míše. Kromě velmi vzácných případů, jako všechny mozkové nádory, nepřesahují struktury centrálního nervového systému.
Glioblastom může vzniknout z difuzního (II. stupně) nebo anaplastický astrocytom (III. stupeň) rozvíjet. V druhém případě se nazývá sekundární. Pokud se však objeví bez předchozího zhoubného nádoru nebo důkazu o předchozím zhoubném bujení, označuje se jako primární. Glioblastomy se léčí chirurgicky, ozařováním a chemoterapií. Jsou obtížně léčitelné a jen málo případů přežívá déle než tři roky.
Oligodendrogliomy
Oligodendrogliom je neobvyklý gliový nádor mozku, který vzniká z oligodendrocytů. Vyskytuje se především u dospělých mezi 40. a 45. rokem života, přednostně v mozkové kůře a bílé hmotě mozkových hemisfér.
Oligodendrogliomy jsou relativně vzácné, tvoří méně než asi 5 procent všech primárních mozkových nádorů a ne více než asi 10 až 15 procent všech gliomů. Tyto nádory se dělí na léze nízkého stupně a anaplastické léze. Anaplastický oligodendrogliom je charakterizován zvýšenou hustotou buněk, mitózou, endoteliální proliferací a jaderným polymorfismem a nekrózou.
Oligodendrogliomy a oligoastrocytomy nízkého stupně
Medián přežití u pacientů s čistým oligodendrogliomem je asi 10 let, s oligoastrocytomem asi 8 let. Prodloužení ve srovnání s čistými astrocytomy je způsobeno delecí nebo translokací páru 1p/19q v nádoru.
Průměrný věk pacientů v době diagnózy je 35 let. Typickými příznaky jsou epileptické záchvaty, ale mohou být hlášeny i fokální neurologické deficity, změny osobnosti nebo jiné příznaky intrakraniálního tlaku, jako je bolest hlavy a zvracení. Tyto nádory nejsou obvykle viditelné na počítačové tomografii, takže MRI je metodou volby pro diagnostické zobrazování. Na - Magnetická rezonance, jsou rozpoznatelné jako zvýšená intenzita signálu. Na -obrázky, naopak signál lze ztlumit a zvýšení kontrastu lze detekovat jen občas. Může chybět signál kalcifikace.
Tyto nádory se vyvíjejí pomaleji než astrocytomy nízkého stupně a v literatuře neexistuje shoda ohledně optimální léčby. Počáteční léčba zahrnuje kontrolu příznaků pomocí léků proti záchvatům, ozařování, chemoterapie nebo kombinace posledních dvou. Při recidivách hraje důležitou roli operace, radioterapie a chemoterapie. Resekce mohou zmírnit příznaky. Temozolomid ukázal 50 Procento pacientů, kteří po radioterapii relapsují, má pozitivní reakci.
Anaplastické oligodendrogliomy a oligoastrocytomy
Anaplastické oligodendrogliomy vykazují typické příznaky vyplývající z hromadného účinku a epileptických záchvatů. Navzdory jejich chemosenzitivitě je medián přežití pouze 3 do 5 let. Léčba zahrnuje co nejvíce excize, po které následuje radiační terapie. Pokud jde o chemoterapii, je třeba poznamenat, že dvě nedávné klinické studie fáze III porovnávaly výsledky radioterapie s výsledky kombinované radioterapie a chemoterapie prokarbazin, lomustin a vinkristin. Přestože přežití bez relevantních příznaků bylo delší při kombinované terapii, celkové přežití bylo u obou terapií stejné. Pacienti s delecí 1p/19q dosáhli nejlepších léčebných výsledků, zatímco pacienti bez delece 1p/19q byli schopni zlepšit své výsledky pomocí chemoterapie PCV.
Prospektivní klinické studie ukázaly, že asi 50 do 70 Procento pacientů s recidivujícím anaplastickým oligodendrogliomem po radioterapii reaguje pozitivně na chemoterapii s PCV nebo temozolomidem. Ačkoli vyšší účinnost terapie temozolomidem a PCV nebyla stanovena, nedostatek kumulativní myelosuprese u temozolomidu naznačuje jeho použití na začátku léčby relapsu.
Ependymomy

Ependymom je novotvar, který se vyvíjí z ependymových buněk lemujících mozkové komory, choroidální plexus, filum terminale a centrální kanál míchy. Ependymální buňky jsou také přítomny v mozkovém parenchymu jako výsledek embryonální migrace z periventrikulárních oblastí do mozkové kůry.
Tyto poměrně vzácné nádory se mohou objevit v jakémkoli věku, ale mají dva charakteristické vrcholy, od 0 do 10 a od 40 do 50 let. Intrakraniální poranění, která se obvykle vyskytují v zadní jámě, jsou častější v první věkové skupině, zatímco poranění páteře jsou častější ve druhé věkové skupině.
Ependymomy se dělí na léze nízkého stupně (I. a II. stupně na stupnici WHO) a anaplastické léze (III. stupně) rozdělené. I. stupně jsou zejména subependymomy a myxopapilární ependymomy, III. Anaplastický ependymom. Pacienti s ependymomy nízkého stupně na páteři, které lze zcela odstranit, nepodstupují poté radiační terapii. Role pooperační radioterapie u intrakraniálních ependymomů nízkého stupně malignity je kontroverzní, ale léčba radioterapií je obvykle indikována u anaplastických nebo nádorů nízkého stupně, které nelze zcela resekovat.
Klinické studie ukázaly, že ependymomy reagují na chemoterapii, zejména na ty na bázi platiny. Přínos chemoterapie na bázi platiny je 67 Procento, na druhou stranu 25 u nitrosomočovin Procent. Prognóza ependymomů II. Stupně jsou 6leté přežití bez onemocnění 68 procent a s celkovým přežitím 87 Procent. U anaplastických ependymomů tyto hodnoty klesnou na 29 procent nebo na 37 Procent.
Negliové nádory
Meduloblastomy
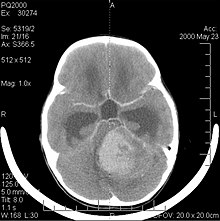
Meduloblastom je nejčastějším zhoubným nádorem mozku u dětí. Nejvyšší výskyt se vyskytuje u dětí ve věku od 2 do 7 let. Největší riziko onemocnění zůstává v dětském věku, protože u lidí starších 21 let je meduloblastom velmi vzácný.
Tento nádor je typický pro zadní jámu, kde je lokalizován v obou hemisférách mozečku nebo v cerebelární vermis. Protože je invazivní a rychle roste, obvykle se šíří do jiných částí centrálního nervového systému (CNS) prostřednictvím CSF a může infiltrovat dno blízké čtvrté komory a mozkových blan. Vzácně se mohou objevit další metastázy do CNS. Když se objeví malignita, symptomy zahrnují ztrátu rovnováhy, nekoordinovanost, diplopii, dysartrii a v důsledku postižení čtvrté komory, což často vede k obstrukčnímu hydrocefalu, bolesti hlavy, nevolnosti a zvracení a nestabilní chůzi.
MRI obvykle ukazuje masivní lézi zvyšující kontrast zahrnující cerebellum. Jak již bylo zmíněno výše, meduloblastom má vysoký sklon k lokální infiltraci leptomeningů a také k šíření přes subarachnoidální prostor, zahrnující komory, mozkovou konvexitu a leptomeningeální povrchy páteře. Následně je nutné uvést do rezonance celou kraniospinální osu.
Účelem operace je odstranit co nejvíce hmoty představované lézí. Ve skutečnosti mají pooperační reziduální nádory za následek horší prognózu. Předzvěstí nepříznivé prognózy je také přítomnost nádorových buněk v mozkomíšním moku nebo rezonanční průkaz leptomeningeálních metastáz. Samotná operace obvykle není léčebná. V některých případech však může dojít k terapeutickému ozáření kraniospinální osy, zaměřené na primární ložisko nádoru. Přidání chemoterapie po radioterapii zvyšuje rychlost vyléčení. Spolu s vinkristinem se používají léky na bázi platiny (cisplatina nebo karboplatina), etoposid a alkylační činidlo (cyklofosfamid nebo lomustin). Při vhodné léčbě se případy dlouhého přežití více než 3 roky u pacientů s meduloblastomem pohybují od 60 do 60 let a 80 Procent.
Meningeomů

Meningeomy jsou nejběžnější intrakraniální vnější nebo extraaxiální mozkové nádory, které vznikají z buněk arachnoidu, membrány, která vystýlá mozek a míchu. Incidence této neoplazie je asi 2 případy per rok za 100 000 Rezident. Častěji se vyskytují u žen v šesté a sedmé dekádě. Jejich frekvence je vyšší u pacientů s neurofibromatózou 2. typu. Ztráta chromozomu 22 je charakteristický pro meningeomy, i když prognostický význam tohoto nálezu je stále nejasný.
U pacientů s meningeomem se mohou projevit příznaky typické pro masivní léze lebky, včetně záchvatů a fokálních neurologických deficitů. Vzhledem k tomu, že meningiom může být i asymptomatický, jsou někdy detekovány na počítačové tomografii a magnetické rezonanci z jiných důvodů. Tento rezonanční tumor má charakteristický vzhled, obvykle sestávající z rovnoměrného zesílení kontrastu podél tvrdé pleny s jasným oddělením od mozkového parenchymu. Dalším znakem, i když není přítomen ve všech případech, je takzvaný „durální ocas“, reprezentovaný vyboulením, které přesahuje léze a označuje kotevní bod v tvrdé pleně.
Mnoho náhodně objevených meningeomů nevyžaduje léčbu v době počáteční diagnózy. Pokud je u pacienta zjištěn významný masový efekt, ať už jsou symptomy přítomny či nikoli, je léčbou volby obvykle kompletní resekce. Ve studiu Mayo Clinics porovnávající míru kontroly nádoru po chirurgické resekci a radiochirurgii u pacientů s malým až středně těžkým intrakraniálním meningeomem a bez příznaků hromadného účinku vedla radiochirurgie k lepší kontrole (98 oproti 88 procent) a s menším počtem komplikací (10 oproti 22 procent) ve srovnání s chirurgickým odstraněním.
Primární lymfomy CNS

Primární lymfom centrálního nervového systému tvoří asi 2 procenta na 3 procent všech mozkových nádorů u pacientů s normálním imunitním systémem. Častěji se vyskytují u mužů nad 55 let až 60 let nahoru. Téměř polovina všech lymfomů se vyskytuje u pacientů starších 60 let a asi čtvrtina u pacientů starších 70 let nahoru. Zdá se, že výskyt se zvyšuje s věkem, ale důvod je stále nejasný. Pacienti s oslabeným imunitním systémem jsou vystaveni vyššímu riziku vzniku lymfomu CNS, takže ti, kteří mají transplantovaný orgán, mají vrozenou imunodeficienci nebo autoimunitní onemocnění nebo jsou infikováni virem lidské imunodeficience. Mozkové lymfomy spojené s HIV jsou spojeny s virem Epstein-Barrové, zejména u pacientů s počtem CD4 lymfocytů pod 500 buňky za kubických milimetrů v krvi. Většina lymfomů CNS jsou typu difuzní velkobuněčné B-lymfomy.
Pacienti trpí řadou charakteristických symptomů fokální nebo multifokální masivní léze. MRI obvykle ukazuje nádory s homogenním zvýšením kontrastu v hluboké periventrikulární bílé hmotě. Pro pacienty s oslabeným imunitním systémem je typická multifokalita a nehomogenní zesílení. Analýza lymfomu CNS je mimořádně důležitá v diferenciální diagnostice neoplazie mozku. Je třeba poznamenat, že podávání kortikosteroidů může vést k úplnému vymizení zesílení, což ztěžuje diagnostiku lézí. V důsledku toho, má-li být lymfom CNS zvažován v diferenciální diagnóze, je třeba se kortikosteroidům vyhnout, pokud hromadný účinek nezpůsobí u pacienta závažný a bezprostřední problém.
Biopsie suspektní léze je zásadní. Na rozdíl od systémového velkobuněčného B-lymfomu, u kterého je účinná jak chemoterapie, tak radioterapie a léčba lokalizovaných lézí je kurativní, lymfom centrálního nervového systému obvykle reaguje na počáteční terapii, ale pak se recidivuje. Stejně jako u systémového lymfomu je role chirurgie primárně omezena na získání vhodných vzorků tkáně pro diagnostiku.
V minulosti se radiační terapie podávala na celý mozek (panencefalická). Medián přežití je asi 12 i s lokalizovanými lézemi měsíce. Recidiva obvykle postihuje místo předchozího poranění i jiné oblasti. Reakce na chemoterapii jsou slibnější. Klinické studie, ve kterých byla jako první léčba použita samotná vysoká dávka methotrexátu a radioterapie byla odložena až do doby relapsu nebo progrese, prokázaly lepší celkové přežití než samotná radioterapie. Ještě účinnější byla kombinace methotrexátu, vinkristinu, prokarbazinu, intratekálního metotrexátu, cytarabinu a panencefalické radioterapie a cytarabinu nebo použití intraarteriální chemoterapie intraarteriálním methotrexátem, intravenózně injekčně cyklofosfamidem a etoposidem po úpravě krve mozková bariéra s manitolem. Medián přežití při léčbě methotrexátem byl 24 do 40 měsíců mnohem vyšší než při samotné radioterapii (rozmezí 24 až do 40 měsíců). V některých případech se radiační terapie používá pouze u relapsů, když dojde k počáteční regresi s chemoterapií. Byly hlášeny i případy dlouhého přežití bez radioterapie.
Panencefalická radiační terapie je spojena s vysokým rizikem rozvoje demence nebo leukoencefalopatie. Toto riziko by mohlo být sníženo vyvinutím účinných strategií kontroly nádoru, které by se vyhnuly panencefalické radioterapii. Počáteční terapie u pacientů s oslabeným imunitním systémem má snížit příčiny imunosuprese. Prognóza u těchto pacientů je obvykle horší než u pacientů s normálním imunitním systémem. Vzhledem k doprovodným nádorovým infekcím a celkově suboptimálnímu fyzickému stavu nelze u těchto imunosuprimovaných pacientů často provádět chemoterapii. Stejně jako u jiných mozkových nádorů závisí odpověď na léčbu na věku a fyzickém stavu.
Metastatické nádory centrálního nervového systému
Mozkové metastázy
Mozkové metastázy jsou nejčastějšími intrakraniálními novotvary u dospělých, jsou desetkrát častější než primární mozkové nádory. Krokují na 20 do 40 procenta dospělých s rakovinou a jsou spojeny hlavně s rakovinou plic a prsu a melanomem. Tyto léze jsou výsledkem šíření rakovinných buněk krevním řečištěm a nejčastěji se vyskytují na křižovatce šedé a bílé hmoty, kde se mění průřez krevních cév a zachycují embolie nádorových buněk. 80 procento lézí se vyskytuje v mozkových hemisférách, 15 procenta v mozečku a 5 procent v mozkovém kmeni. Asi 80 procento pacientů má v anamnéze systémovou rakovinu a 70 procento má četné mozkové metastázy.

V diagnostice a léčbě těchto lézí bylo nedávno dosaženo významného pokroku, jehož výsledkem je lepší přežití a kontrola symptomů. Nástup známek a symptomů je podobný jako u jiných masivních lézí v mozku. Diagnostickou metodou volby je magnetická rezonance s použitím kontrastních látek.
Literatura uvádí ekvivalentní výsledky pro chirurgii a radiochirurgii. Posledně jmenované se jeví jako pohodlnější, účinnější a bezpečnější pro malé léze nebo v oblastech nepřístupných pro chirurgii. Radiochirurgie je rozumnou alternativou pro pacienty, kteří nemohou být ze zdravotních důvodů operováni. Chirurgie je však jednoznačně optimální metodou k získání tkání pro diagnostiku a odstranění lézí, které způsobují masový efekt. Radiochirurgie a chirurgie by proto měly být lépe považovány za dvě komplementární, ale odlišné metody, které je třeba aplikovat v závislosti na různé situaci pacienta. Za skoro 50 procento pacientů s jednou nebo dvěma mozkovými metastázami není kandidáty na chirurgické odstranění kvůli nepřístupnosti lézí, rozsahu systémového onemocnění nebo jiným faktorům. Těmto a dalším pacientům s mnohočetnými metastázami je obvykle nabízena panencefalická radiační terapie jako standardní péče. Ve skutečnosti dosahují až téměř 50 procent z nich touto terapií zlepšení neurologických příznaků a 50 do 70 procent znatelná reakce. Chemoterapie se zřídka používá především u mozkových metastáz.
U většiny pacientů s mozkovými metastázami je medián přežití pouze čtyři až šest měsíců po panencefalické radiační terapii. Pacienti mladší 60 let s diskrétními lézemi a kontrolovaným systémovým onemocněním však mohou dosáhnout delšího přežití, protože mohou tolerovat agresivnější léčebný přístup.
Meningeální metastázy

Kolem 5 u procent pacientů s nádorem lze diagnostikovat metastázy měkkých mozkových blan (leptomeninges encephali). Nejčastěji se vyskytují u melanomu, rakoviny prsu a plic v důsledku šíření nádorových buněk krevním řečištěm. Zhoubné buňky se pak šíří po celém centrálním nervovém systému (CNS), obecně prostřednictvím mozkomíšního moku, běžně známého jako mozková tekutina. Jeden nebo více z následujících příznaků a symptomů může být způsobeno mimo jiné meningeálními metastázami:
- lokální poškození nervů, jako je paralýza hlavových nervů, motorická slabost a radikulopatie, parestézie a bolest,
- přímá invaze do mozku nebo míšní tkáně,
- Poruchy krevních cév v mozku a páteři s fokálními neurologickými deficity a/nebo záchvaty,
- Překážky normálního průtoku mozkomíšního moku s bolestmi hlavy a zvýšeným intrakraniálním tlakem,
- Poruchy normální funkce mozku, jako je encefalopatie a/nebo
- perivaskulární infiltrace nádorovými buňkami s výslednými symptomy ischemie a apoplexie.
Diagnózu lze stanovit vyšetřením mozkomíšního moku nebo magnetickou rezonancí mozku a míchy. Přítomnost maligních buněk lze měřit při 50 lze identifikovat procento pacientů. Minimálně 10 procent pacientů s leptomeningeálním postižením zůstává při cytologickém vyšetření negativní. Zvýšením počtu lumbálních punkcí až na šest a množství odstraněného objemu tekutiny na 10 Mililitr na punkci může zvýšit možnost pozitivní diagnózy. V mozkomíšním moku je koncentrace proteinů obvykle vysoká, koncentrace glukózy může být nízká v přítomnosti pleocytózy. Radiografická studie může ukázat hydrocefalus bez masivní léze nebo difuzního zvětšení leptomeningů.
Bez terapie je medián přežití 4 do 6 týdne, se smrtí v důsledku progresivního neurologického zhoršení. Leptomeningeální metastázy jsou často projevem konečného stadia hlavního onemocnění a symptomatická terapie může být nejvhodnějším řešením. Kortikosteroidy a analgetika poskytují dočasnou úlevu. Léčba může být nabídnuta pacientům s minimálním systémovým onemocněním a přijatelným celkovým fyzickým stavem ke zmírnění symptomů a prodloužení přežití.
Střední přežití lze zlepšit radioterapií na symptomatická místa a objemnější nemocné oblasti identifikované rentgenem a intratekální terapií methotrexátem, cytarabinem a thiotepou, prováděnou lumbální punkcí nebo Ommaya katétrem, od 3. dne 6 měsíce se zvyšují.
Hlavní komplikací intratekální terapie založené na methotrexátu je nekrotizující leukoencefalopatie, která se může vyvinout po měsících léčby u těch několika pacientů, kteří se mohou těšit z prodlouženého přežití. Tento devastující toxický účinek je zvláště častý u pacientů, kteří dříve nebo současně podstoupili radioterapii s intratekální léčbou methotrexátem.
Bolest a terminální péče
Paliativní péče je speciální forma péče určená ke zlepšení kvality života pacientů trpících závažným nebo život ohrožujícím onemocněním, jako je rakovina. Cílem paliativní péče není vyléčit, ale co nejdříve předcházet nebo léčit symptomy a vedlejší účinky nemoci a její léčbu, stejně jako psychické, sociální a duchovní problémy s ní spojené. Paliativní péče je také známá jako komfortní péče, podpůrná péče a zvládání symptomů.
Paliativní péče je poskytována po celou dobu pacientovy zkušenosti s rakovinou. Obvykle začíná diagnózou a pokračuje léčbou, následnou péčí a koncem života.
Externí odkazy
- www.cochrane.org/pt/evidence – COCHRANE - Neuro-Oncology Group
- www.eano.eu – European Association of Neuro-Oncology
- https://www.eortc.org/research_field/brain/ – The European Organisation for Research and Treatment of Cancer (EORTC)
Literatura
- Jan C. Buckner et al., Central Nervous System Tumors, Mayo Clinic Proceedings, Jg. 82, 2007, lado 1271-1286
- Lisa M. DeAngelis et al., Intracranial Tumors. Diagnosis and Treatment, Dunitz London, 2002, ISBN 1-901865-37-1
- D. N. Louis et al., WHO Classification of Tumours of the Central Nervous System, Genf, 2007, ISBN 978-92-832-2430-3
- Richard Pazdur et al., Cancer management. A multidisciplinary approach. Medical, surgical, & radiation oncology, UBM Medica, 2010, ISBN 978-0-615-41824-7
- Jerome B. Posner, Neurologic Complications of Cancer, Davis, Philadelphia, 1995, ISBN 0-8036-0006-2
- Rüdiger Schenk, Neuroonkologische Therapiekonzepte zur Behandlung von Astrozytomen höheren Malignitätsgrades und Rezidivlokalisation, Regensburg, 2019
- Uwe Schlegel et al., Neuroonkologie, 2. erw., Thieme, Stuttgart, 2003, ISBN 3-13-109062-6
- Jörg-Christian Tonn et al., Oncology of CNS Tumors, Springer, Berlin, 2010, ISBN 978-3-642-02873-1

Přečtěte si prosím pokyny pro využití článků o zdravotnictví.
Média použitá na této stránce
Star of life, blue version. Represents the Rod of Asclepius, with a snake around it, on a 6-branch star shaped as the cross of 3 thick 3:1 rectangles.
Design:
The logo is basically unicolor, most often a slate or medium blue, but this design uses a slightly lighter shade of blue for the outer outline of the cross, and the outlines of the rod and of the snake. The background is transparent (but the star includes a small inner plain white outline). This makes this image usable and visible on any background, including blue. The light shade of color for the outlines makes the form more visible at smaller resolutions, so that the image can easily be used as an icon.
This SVG file was manually created to specify alignments, to use only integers at the core 192x192 size, to get smooth curves on connection points (without any angle), to make a perfect logo centered in a exact square, to use a more precise geometry for the star and to use slate blue color with slightly lighter outlines on the cross, the rod and snake.
Finally, the SVG file is clean and contains no unnecessary XML elements or attributes, CSS styles or transforms that are usually added silently by common SVG editors (like Sodipodi or Inkscape) and that just pollute the final document, so it just needs the core SVG elements for the rendering. This is why its file size is so small.Autor: Fujimaki T, Ishii H, Matsuno A, Arai H, Nakagomi T., Licence: CC BY 2.0
MRI of brain. (A) Initial MRI on February 16, 2005, shows a tumor in the right and left frontal lobe as well as the right thalamus. (B) MRI after surgery, radiation and chemotherapy. The tumor has completely disappeared except for slight enhancement adjacent to the surgical margin. (C) Recurrence of the thalamic tumor despite maintenance chemotherapy on November 16, 2005. (D) Increase in size of the thalamic tumor two months after stereotactic radiotherapy. (E) After 6 cycles of TMZ therapy, the thalamic lesion enlarged, and the patient developed dysarthria and hemiparesis. (F) After 2 courses of treatment with interferon-beta and TMZ, the tumor shows a partial response.
CNS: GLIOBLASTOMA MULTIFORME
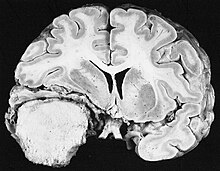
This typical untreated glioblastoma, here with the classic "butterfly" configuration, is a necrotic hemorrhagic mass. (Courtesy of Dr. Rodney D. McComb, Omaha, NE.)CNS: MENINGIOMA
The classic meningioma is a soft, spherical lesion which displaces rather than infiltrates the underlying brain.Autor: User Hellerhoff, Licence: CC BY-SA 3.0
Ependymoma:MRI T2 axial proection. Red line limited tumor
AFIP405851R- MEDULLOBLASTOMA
CNR/Radiology
As seen in this MRI study of a vermian lesion, medulloblastomas are contrast-enhancing masses. Diffuse enhancement in the cerebral subarachnoid space (arrows) indicates leptomeningeal dissemination.Autor: Dr Laughlin Dawes, Licence: CC BY 3.0
"This 59 year-old female patient presented with acute right hemiplegia, aphasia and confusion. She had a known cerebral melanoma metastasis in the left frontal lobe. This axial T2-weighted MR (click image for arrows) shows a large haematoma with a fluid-fluid level (green arrows). There is a smaller low signal area anteriorly (red arrows) which corresponded to the known metastasis. This smaller area enhanced after gadolinium, as did the overlying dura." (dr Dawes)
Autor: No machine-readable author provided. KGH assumed (based on copyright claims)., Licence: CC BY-SA 3.0
Histopathologic image of intracranial meningioma. The author considers it to represent a transitional variant. H & E stain.
Image# 405615 CNS: PILOCYTIC ASTROCYTOMA OF THE HYPOTHALAMIC REGION At this commonly affected site, the contrast-enhancing neoplasm often appears to lie within the third ventricle. Type: Radiology
(c) I, Tdvorak, CC BY-SA 3.0
Primary CNS Lymphoma, MRI, T1 Saggital
Autor: Původně soubor načetl Jensflorian na projektu Wikipedie v jazyce němčina, Licence: CC BY-SA 2.0 de
Meningeosis carcinomatosa: Neben Lymphozyten, Monozyten und Erythrozyten finden sich hier im Liquor mehrere atypische Zellen mit basophilem Zytoplasma. Eigenes Bild
medulloblastoma
CNS: FIBRILLARY OR "DIFFUSE" ASTROCYTIC NEOPLASM WITH DIFFERING DEGREES OF DIFFERENTIATION. A large area of dark magnetic resonance signal representing low-grade astrocytoma is present in the frontal lobe on the left. Higher-grade foci are apparent as the two white contrast-enhancing foci within this darker zone.
(c) I, Tdvorak, CC BY-SA 3.0
Primary CNS Lymphoma, MRI, T1 coronal
Autor: Christaras A, Licence: CC BY 2.5
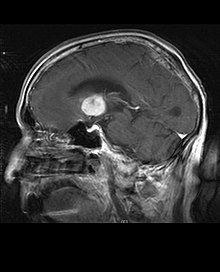
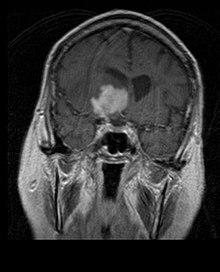
Gliobastoma (astrocytoma) WHO grade IV - MRI sagittal view, post contrast. 15 year old boy.
Autor: RadsWiki, Licence: CC BY-SA 3.0
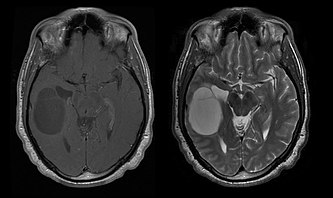
Oligodendroglioma, MRI T1 (left), MRI T2 (right) with gadolinium contrast
Autor: Sbrandner, Licence: CC BY-SA 4.0
Esame microscopico. Controllo GFAP di astrocitoma subependimale a cellule giganti. La Proteina Acida Glio Fibrillare (GFAP) è specifica degli astrociti e delle cellule ependimali del SNC. L'anticorpo monoclonale per GFAP è utile nella differenziazione di gliomi primari da lesioni metastatiche nel cervello e per documentare la differenziazione di astrociti in tumori esterni al SNC.
Autor: No machine-readable author provided. Hermoye~commonswiki assumed (based on copyright claims)., Licence: CC BY-SA 3.0
T1-weighted magnetic resonance imaging (MRI) of a normal brain. White matter (light grey), grey matter (dark grey) and CSF (black) can be clearly identified.
Author = Dr. Laurent Hermoye, [www.imagilys.com Imagilys]Autor: Suarez C, Maglietti F, Colonna M, Breitburd K, Marshall G, Licence: CC BY 2.5
Supplemental video of case 2 tumor growth simulation (anaplastic oligodendroglioma). Simulation was run for 2600 days since tumor onset (one original cell) with a detection level of 1 cell/mm2.