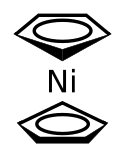
Niklocen
| Niklocen | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | bis(cyklopentadienid) nikelnatý |
| Sumární vzorec | C10H10Ni |
| Vzhled | tmavě zelené krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 1271-28-9 |
| EC-no (EINECS/ELINCS/NLP) | 215-039-0 |
| PubChem | 13628993 |
| ChEBI | 30679 |
| SMILES | [CH-]1C=CC=C1.[CH-]1C=CC=C1.[Ni+2] |
| InChI | 1S/2C5H5.Ni/c2*1-2-4-5-3-1;/h2*1-5H;/q2*-1;+2 |
| Vlastnosti | |
| Molární hmotnost | 188,88 g/mol |
| Teplota tání | 171 °C (444 K)[1] |
| Teplota varu | 4 °C (277 K) (8-10% roztok v toluenu)[1] |
| Hustota | 1,47 g/cm3 |
| Rozpustnost ve vodě | <0,1 g/100 ml[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v toluenu[1] |
| Tlak páry | 1,49 kPa |
| Bezpečnost | |
| [1] | |
| H-věty | H228 H302 H317 H350[1] |
| P-věty | P203 P210 P240 P241 P261 P264 P270 P272 P280 P301+317 P302+352 P318 P321 P330 P333+317 P370+378 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Niklocen je organická sloučenina patřící mezi metaloceny, se vzorcem Ni(η5-C5H5)2, vykazující paramagnetismus. Přestože je niklocen často zkoumán, tak nemá praktické využití.[2]
Struktura
Ni(C5H5)2 má, podobně jako jiné metaloceny, sendvičovou strukturu, kde kation kovu spojuje dva rovnoběžné cyklopentadienylové (Cp) kruhy. V pevném skupenství vykazuje D5d symetrii.[3]
Ni centrum má náboj +2 a navazují se na něj dva cyklopentadienylové anionty (Cp−); struktura je tedy podobná ferrocenu. Trojice párů d elektronů na niklu je rozdělena mezi tři d orbitaly zapojené do vazeb Ni–Cp: dxy, dx2–y2, dz2. Zbylé dva d elektrony se nachází v orbitalech dyz a dxz, v důsledku čehož je molekula paramagnetická, což se projevuje neobvykle vysokým posunem v 1. Niklocen má 20 valenčních elektronů, nejvíce ze všech metalocenů přechodných kovů; kobaltocen (Co(C5H5)2), mající 19 valenčních elektronů, je ale silnějším redukčním činidlem, což ukazuje, že redoxní potenciál je ovlivňován energií elektronů, ne jejich počtem.
Příprava
Niklocen poprvé připravil Ernst Otto Fischer v roce 1953, krátce po objevu ferrocenu jako prvního metalocenu.[4]
Přípravu provedl v jedné nádobě deprotonací cyklopentadienu ethylmagnesiumbromidem a přidáním bezvodého acetylacetonátu nikelnatého.[5]
Častěji se používá reakce bezvodého zdroje NiCl2 (například chloridu hexaamminnikelnatého) s cyklopentadienidem sodným:[6]
- [Ni(NH3)6]Cl2 + 2 NaC5H5 → Ni(C5H5)2 + 2 NaCl + 6 NH3
Vlastnosti
Podobně jako mnoho dalších organokovových sloučenin se Ni(C5H5)2 při delším stání na vzduchu rozkládá.[7]
Většina reakcí niklocenu je vyvolávána jeho snahou přejít na 18elektronové produkty, se ztrátou nebo obměnou jednoho cyklopentadienového kruhu.
- Ni(C5H5)2 + 4 PF3 → Ni(PF3)4 + organické produkty
Podobně reaguje se sekundárními fosfiny:
- 2 Ni(C5H5)2 + 2 PPh2H → [Ni2(PPh2)2(C5H5)2] + 2 C5H6
Niklocen lze oxidovat na příslušný kation, obsahující niklité centrum.
Plynný Ni(C5H5)2 se při styku s horkými povrchy rozkládá na kovový nikl za uvolnění uhlovodíků; tento rozklad lze využít na tvorbu tenkých vrstev niklu.
S kyselinou dusičnou vytváří niklocen nitrosylcyklopentadienylnikl, který je vysoce toxický.
Reference
V tomto článku byl použit překlad textu z článku Nickelocene na anglické Wikipedii.
- ↑ a b c d e f g h https://pubchem.ncbi.nlm.nih.gov/compound/13628993
- ↑ C. Elschenbroich. Organometallics. Weinheim: Wiley-VCH ISBN 978-3-527-29390-2.
- ↑ P. Seiler; J. D. Dunitz. The structure of nickelocene at room temperature and at 101 K. Acta Crystallographica. 1980, s. 2255–2260. DOI 10.1107/S0567740880008539.
- ↑ E. O. Fischer; W. Pfab. Zur Kristallstruktur der Di-Cyclopentadienyl-Verbindungen des zweiwertigen Eisens, Kobalts und Nickels. Zeitschrift für Naturforschung B. 1952, s. 377–379. DOI 10.1515/znb-1952-0701.
- ↑ G. Wilkinson; P. L. Pauson; F. A. Cotton. Bis-cyclopentadienyl Compounds of Nickel and Cobalt. Journal of the American Chemical Society. 1954, s. 1970–1974. DOI 10.1021/ja01636a080.
- ↑ G. S. Girolami; T. B. Rauchfuss; R. J. Angelici. Synthesis and Technique in Inorganic Chemistry. [s.l.]: University Science Books, 1999. Dostupné online. ISBN 0935702482.
- ↑ Anna Jaworska-Augustyniak; Jan Wojtczak. Charge-transfer complexes of cobaltocene and nickelocene with tetrachloromethane. Monatshefte für Chemie. 1979, s. 1113–1121. DOI 10.1007/BF00910959.
Externí odkazy
 Obrázky, zvuky či videa k tématu niklocen na Wikimedia Commons
Obrázky, zvuky či videa k tématu niklocen na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Skeletal reprentation of nickelocene
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances