Nojoriova asymetrická hydrogenace
Nojoriova asymetrická hydrogenace je postup enantioselektivní redukce ketonů a podobných sloučenin; vyvinul ji Rjódži Nojori,[1] jenž získal v roce 2001 za příspěvek k rozvoji asymetrických hydrogenací podíl na Nobelově ceně za chemii. Tyto hydrogenace se používají při výrobě řady léčiv, jako jsou levofloxin, karbapenemová antibiotika a antipsychotikum BMS181100.[2][3]

Historie
Stechiometrická asymetrická redukce ketonů, například hydridy boru, je známá dlouho.[4]
Katalytická asymetrická hydrogenace ketonů byla provedena s katalyzátory založenými na BINAP-Ru halogenidech a karboxylátech.[5][6]
S použitím BINAP-Ru dihalogenidových katalyzátorů lze provádět redukce funkcionalizovaných ketonů, hydrogenace jednoduchých ketonů nebyla tímto způsobem vyřešena. K jejímu provedení posloužily prekatalyzátory typu RuCl2(difosfan)(diamin).[7]
Tyto katalyzátory přednostně redukují ketony a aldehydy, alkeny a četné další skupiny s nimi nereagují.

Mechanismus

BINAP-Ru-diamindihalogenidový prekatalyzátor se na aktivní katalyzátor přeměňuje reakcí s H2 za přítomnosti zásady:[3]
- RuCl2(BINAP)(diamin) + 2 KOBu-t + 2 H2 → RuH2(BINAP)(diamin) + 2 KCl + 2 HOBu-t
Vzniklý katalyzátor má tři druhy ligandů:
- hydridy, které se navazují na nenasycený substrát
- diaminy, interagující se substrátem a se zásaditým aktivátorem
- difosfiny, které zaručují asymetrii.
Nojoriovy katalyzátory se často označují jako bifunkční katalyzátory, protože se do katalýzy zapojují jak kov, tak i aminový ligand.[8] Dlouho se předpokládalo, že je součástí mechanismu šestičlenný pericyklický meziprodukt a hydridorutheniové centrum (HRu-NH) interaguje s karbonylovým substrátem R2C=O.[9]
S využitím teorie funkcionálu hustoty a experimentálních studií se ukázalo, že tento model je z velké části nesprávný; místo toho aminová skupina silně interaguje se zásaditým aktivátorem, který se často používá ve velkém přebytku.[3]
Možné substráty
BINAP/diamin-Ru katalyzátory jsou účinné při asymetrických redukcích funkcionalizovaných i jednoduchých ketonů[10] a lze s jejich využitím enantioselektivně redukovat také aromatické, heteroaromatické a alkenové ketony.[7] Lepší stereoselektivity se dosáhne tehdy, když je jeden substituent větší než druhý.

Průmyslová využití
Hydrogenanční katalyzátory inspirované Nojoriovými mají využití v průmyslové výrobě řady látek. (R)-propan-1,2-diol, prekurzor antibiotika levofloxacinu, může být velmi účinně získáván Nojoriovou asymetrickou hydrogenací hydroxyacetonu:[2]
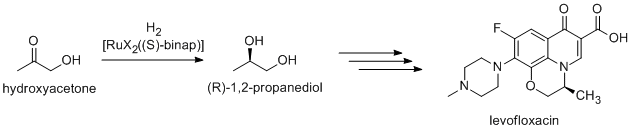
Novější postupy jsou zaměřené na hydrogenaci (R)-methyllaktátu.[3]
Součástí výroby antibiotika karbapenemu je také Nojoriova asymetrická hydrogenace, jejím meziproduktem je (2S,3R)-methyl-2-(benzamidomethyl)-3-hydroxybutanoát, jenž se získává z racemického methyl-2-(benzamidomethyl)-3-oxobutanoátu s využitím dynamického kinetického rozlišení.

Antipsychotikum BMS 181100 se vyrábí za katalýzy BINAP/diamin-Ru.

Odkazy
Související články
- Midlandova redukce
- Coreyova-Itsunova redukce
- MACHO katalyzátor
Externí odkazy
 Obrázky, zvuky či videa k tématu Nojoriova asymetrická hydrogenace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Nojoriova asymetrická hydrogenace na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Noyori asymmetric hydrogenation na anglické Wikipedii.
- ↑ R. Noyori; T. Ohkuma; M. Kitamura; H. Takaya; N. Sayo; H. Kumobayashi; S. Akutagawa. Asymmetric hydrogenation of β-keto carboxylic esters. A practical, purely chemical access to .beta.-hydroxy esters in high enantiomeric purity. Journal of the American Chemical Society. 1987, s. 5856–5858. DOI 10.1021/ja00253a051.
- ↑ a b R. Noyori. Asymmetric Catalysis: Science and Opportunities (Nobel Lecture). Angewandte Chemie International Edition. 2002, s. 2008–2022. DOI 10.1002/1521-3773(20020617)41:12<2008::aid-anie2008>3.0.co;2-4. PMID 19746595.
- ↑ a b c d e Pavel A. Dub; John C. Gordon. The role of the metal-bound N–H functionality in Noyori-type molecular catalysts. Nature Reviews Chemistry. 2018, s. 396–408. DOI 10.1038/s41570-018-0049-z.
- ↑ P. V. Ramachandran; H. C. Brown. Recent Advances in Asymmetric Reductions with B-Chlorodiisopinocampheylborane. Journal of the American Chemical Society. 1996, s. 84–97. ISBN 0-8412-3381-0. DOI 10.1021/bk-1996-0641.ch005.
- ↑ K. Mashima, K.-h. Kusano, N. Sato, Y.-i. Matsumura, K. Nozaki, H. Kumobayashi, N. Sayo, Y. Hori, T. Ishizaki. Cationic BINAP-Ru(II) Halide Complexes: Highly Efficient Catalysts for Stereoselective Asymmetric Hydrogenation of α- and β-Functionalized Ketones. The Journal of Organic Chemistry. 1994, s. 3064–3076. DOI 10.1021/jo00090a026.
- ↑ M. Kitamura, T. Ohkuma, S. Inoue, N. Sayo, H. Kumobayashi, S. Akutagawa, T. Ohta, H. Takaya, R. Noyori. Homogeneous Asymmetric Hydrogenation of functionalized ketones. Journal of the American Chemical Society. 1988, s. 629–631. DOI 10.1021/ja00210a070.
- ↑ a b R. Noyori; T. Ohkuma. Asymmetric Catalysis by Architectural and Functional Molecular Engineering: Practical Chemo- and Stereoselective Hydrogenation of Ketones. Angewandte Chemie International Edition. 2001, s. 40–73. DOI 10.1002/1521-3773(20010105)40:1<40::aid-anie40>3.0.co;2-5. PMID 11169691.
- ↑ Ryōji Noyori; Masashi Yamakawa; Shohei Hashiguchi. Metal−Ligand Bifunctional Catalysis: A Nonclassical Mechanism for Asymmetric Hydrogen Transfer between Alcohols and Carbonyl Compounds. The Journal of Organic Chemistry. 2001-11-01, s. 7931–7944. DOI 10.1021/jo010721w. PMID 11722188.
- ↑ T. Ohkuma; H. Ooka; T. Ikariya; R. Noyori. Preferential hydrogenation of aldehydes and ketones. Journal of the American Chemical Society. 1995, s. 10417–10418. DOI 10.1021/ja00146a041.
- ↑ T. Ohkuma; H. Ooka; M. Yamakawa; T. Ikariya; R. Noyori. Stereoselective Hydrogenation of Simple Ketones Catalyzed by Ruthenium(II) Complexes. The Journal of Organic Chemistry. 1996, s. 4872–4873. DOI 10.1021/jo960997h.
Média použitá na této stránce
Levofloxacin3
Autor: Smokefoot, Licence: CC BY-SA 4.0
intermediates proposed for Noyori asym hydrogenation
Autor: Smokefoot, Licence: CC BY-SA 4.0
Ikariya-style catalyst for asymmetric hydrogenation






