o-Toluidin
| o-toluidin | |
|---|---|
 Strukturní vzorec | |
| Obecné | |
| Systematický název | 2-methylanilin |
| Ostatní názvy | 2-methylbenzen-1-amin, 1-amino-2-methylbenzen, o-toluidin |
| Sumární vzorec | C7H9N |
| Vzhled | bezbarvá až nažloutlá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 95-53-4 |
| EC-no (EINECS/ELINCS/NLP) | 202-429-0 |
| PubChem | 7242 |
| SMILES | CC1=CC=CC=C1N[1] |
| InChI | 1/C7H9N/c1-6-4-2-3-5-7(6)8/h2-5H,8H2,1H3 |
| Číslo RTECS | XU2975000 |
| Vlastnosti | |
| Molární hmotnost | 107,20 g/mol |
| Teplota tání | −16,3 °C (256,8 K)[1] |
| Teplota varu | 200,3 °C (473,4 K)[1] |
| Hustota | 0,998 g/cm3 (20 °C)[1] |
| Viskozita | 3,823 mPas[1] |
| Disociační konstanta pKa | 4,44 (konjugovaná kyselina)[1] |
| Rozpustnost ve vodě | 1,66 g/100 ml[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethanolu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v diethyletheru a tetrachlormethanu[1] |
| Tlak páry | 34,5 kPa[1] |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −6,3 kJ/mol[1] |
| Standardní molární spalná entalpie ΔH°sp | −40,3 MJ/mol[1] |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H301 H319 H331 H350 H400[1] |
| P-věty | P201 P202 P261 P264 P270 P271 P273 P280 P281 P301+310 P304+340 P305+351+338 P308+313 P311 P321 P330 P337+313 P391 P403+233 P405 P501[1] |
| Teplota vzplanutí | 85 °C (358 K)[1] |
| Teplota vznícení | 482 °C (755 K)[1] |
Některá data mohou pocházet z datové položky. | |
o-Toluidin (systematický název 2-methylanilin) je organická sloučenina, aminovaný derivát toluenu. Jedná se o nejvýznamnější látku ze skupiny toluidinů, monoaromatických uhlovodíků, které mají na benzenové jádro navázanou jednu aminovou a jednu methylovou skupinu. V čisté podobě se jedná o bezbarvou kapalinu, běžně prodávané vzorky jsou často nažloutlé. Používá se na výrobu herbicidů metolachloru a acetochloru.[2]
Výroba a reakce
o-Toluidin se vyrábí nitrací toluenu, při které vniká směs nitrotoluenů, přičemž mezi produkty převažuje o-izomer. Z této směsi se destilací oddělí 2-nitrotoluen, který je následně hydrogenován na o-toluidin.[2]
Přeměnu o-toluidinu na diazoniovou sůl lze použít k získání 2-brom, 2-kyano- a 2-chlortoluenu.[3][4][5] Byla také popsána N-acetylace.[6]
Metabolismus
Absorpce, distribuce a vylučování
o-Toluidin se do těla může dostat vdechnutím nebo přes kůži. Byla pozorována absorpce této látky trávicí soustavou.[7][7][8][9][10] Většina o-toluidinu se vylučuje močí, přičemž z toho až třetina v nezměněné podobě. Hlavním metabolitem je 4-amino-m-krezol a v menším množství se tvoří také N-acetyl-4-amino-m-krezol,[9] azoxytoluen, o-nitrosotoluen, N-acetyl-o-toluidin, N-acetyl-o-aminobenzylalkohol, kyselina anthranilová, kyselina N-acetyl-anthranilová, 2-amino-m-krezol a p-hydroxy-o-toluidin. Nejčastější konjugáty jsou ty se síranovými ionty, jež se vytvářejí v přibližně šestkrát větším množství než glukuronidové. Metabolismus o-toluidinu se skládá z řady aktivačních i deaktivačních procesů, jako jsou N-acetylace, N-oxidace a N-hydroxylace, oxidace cyklu.[11] U krys jsou nejvýznamnějšími způsoby metabolizace 4-hydroxylace a N-acetylace. Primární metabolismus o-toluidinu probíhá v endoplazmatickém retikulu. Vystavení organismu o-toluidinu vede ke zvýšení mikrozomální aktivitu arylhydroxylázy, NADPH—cytochrom-c2 reduktázy a množství cytochromu P-450. BV játrech probíhá cytochromem P450 řízená N-hydroxylace na N-hydroxy-o-toluidin, který je karcinogenní. N-Hydroxy-o-toluidin může být metabolizován na o-nitrosotoluen i konjugován s kyselinou glukuronovou i sírany krví se dostat do močového měchýře. kde dochází k uvolnění N-hydroxy-o-toluidinu v kyselém prostředí a ten může přímo reagovat s DNA nebo být aktivován sulfatací či acetylací cytozolovými sulfotransferázami nebo N-acetyltransferázami (hlavně NAT1).[12] Předpokládaná aktivní forma, N-acetoxy-o-toluidin, je reaktivní ester. který vytváří elektrofilní arylnitreniové ionty, jež se mohou vázat DNA.[11][13][14] Dalšími způsoby aktivace jsou peroxidační reakce vedoucí ke vzniku reaktivních metabolitů (chinoniminů vznikajících z nekonjugovaných fenolových metabolitů). Tyto metabolity mohou vytvářet reaktivní formy kyslíku, což vede k oxidativnímu poškození buněk.[15][16] Tento mechanismus podporují pozorování o-toluidinem způsobených poškození DNA u uměle pěstovaných buněk lidského močového měchýře a buněk krys a myší vystavených in vivo o-toluidinu.[17][18]
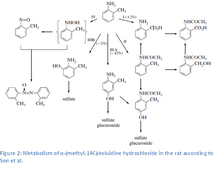
Vazba na hemoglobin
Metabolity o-toluidinu se u krys vážou na hemoglobin;[19] příslušným metabolitem je pravděpodobně o-nitrosotoluen,[14][20] který je pro krysy karcinogenní.[21] Nitrosotoluen přeměňuje hemoglobin na methemoglobin, čímž způsobuje methemoglobinémii.[22][23] Byly nalezeny důkazy o tom, že podobně je o-toluidin metabolizován i u člověka.[11]
Karcinogenita
I když mechanismus karcinogenity o-toluidinu není zcela popsán, tak z dostupných dat vyplývá, že je složitý a skládá se z několika dílčích procesů, jako je metabolická aktivace vedoucí k vazbě reaktivních metabolitů na DNA a bílkoviny, mutagenita, oxidativní poškozování DNA a cytotoxicita.[15][16]
Reference
V tomto článku byl použit překlad textu z článku o-Toluidine na anglické Wikipedii.
- ↑ a b c d e f g h i j k l m n o p q r s o-Toluidine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b Ullmann's Encyclopedia of Industrial Chemistry. Příprava vydání Wiley-VCH. 1. vyd. [s.l.]: Wiley Dostupné online. ISBN 978-3-527-30385-4, ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a27_159. (anglicky) DOI: 10.1002/14356007.
- ↑ H. T. Clarke; R. R. Read. o-Tolunitrile and p-Tolunitrile. Organic Syntheses. 1925, s. 69. DOI 10.15227/orgsyn.004.0069.
- ↑ L. A. Bigelow. o-Bromotoluene. Organic Syntheses. 1929, s. 22. DOI 10.15227/orgsyn.009.0022.
- ↑ C. S. Marvel; S. M. McElvain. o-Chlorotoluene and p-Chlorotoluene. Organic Syntheses. 1923, s. 33. DOI 10.15227/orgsyn.003.0033.
- ↑ Rolf Huisgen; Klaus Bast. Indazole. Organic Syntheses. 1962, s. 69. DOI 10.15227/orgsyn.042.0069.
- ↑ a b K. Cheever; D. Richards; H. Plotnick. Metabolism of o-, m- and p-toluidine in the adult male rat. Toxicol. Appl. Pharm.. 1980, s. 361–369. DOI 10.1016/0041-008x(80)90069-1. PMID 7222020.
- ↑ R. C. Hiles; K. M. Abdo. Nitrogen and Phosphorus Solvents. Příprava vydání D. R. Buhler, D. J. Reed. [s.l.]: Elsevier, 1990. Kapitola 5. ortho-Toluidine, s. 202–207.
- ↑ a b O. S. Son; D. W. Everett; E. S. Fiala. Metabolism of o-[methyl-14C]toluidine in the F344 rat. Xenobiotica. 1980, s. 457–468. DOI 10.3109/00498258009033781. PMID 7445517.
- ↑ W. J. Brock; S. G. Hundley; P. H. Lieder. Hepatic macromolecular binding and tissue distribution of ortho- and para-toluidine in rats. Toxicology Letters. 1990, s. 317–325. DOI 10.1016/0378-4274(90)90199-v. PMID 1701932.
- ↑ a b c K. Riedel; G. Scherer; J. Engl; H. W. Hagedorn; A. R. Tricker. Determination of three carcinogenic aromatic amines in urine of smokers and nonsmokers. Journal of Analytical Toxicology. 2006, s. 187–195. DOI 10.1093/jat/30.3.187. PMID 16803653.
- ↑ 'o-Toluidine [online]. US National Institute of Health. Dostupné online.
- ↑ F. F. Kadlubar; A. F. Badawi. Genetic susceptibility and carcinogen-DNA adduct formation in human urinary bladder carcinogenesis. Toxicology Letters. 1995, s. 627–632. Dostupné online. DOI 10.1016/0378-4274(95)03507-9. PMID 8597119.
- ↑ a b J. C. English; V. S. Bhat; G. L. Ball; C. J. McLellan. Establishing a total allowable concentration of o-toluidine in drinking water incorporating early lifestage exposure and susceptibility. Regulatory Toxicology and Pharmacology. 2012, s. 269–284. Dostupné online. DOI 10.1016/j.yrtph.2012.08.011. PMID 22940434.
- ↑ a b Y. Y. Ohkuma; S. Hiraku; S. Oikawa; N. Yamashita; M. Murata; S. Kawanishi. Distinct mechanisms of oxidative DNA damage by two metabolites of carcinogenic o-toluidine. Archives of Biochemistry and Biophysics. 1999, s. 97–106. DOI 10.1006/abbi.1999.1461. PMID 10562421.
- ↑ a b C. Watanabe; T. Egami; K. Midorikawa; Y. Hiraku; S. Oikawa; S. Kawanishi; M. Murata. DNA damage and estrogenic activity induced by the environmental pollutant 2-nitrotoluene and its metabolite. Environmental Health and Preventive Medicine. 2010, s. 319–326. DOI 10.1007/s12199-010-0146-1. PMID 21432561.
- ↑ L. Robbiano; R. Carrozzino; M. Bacigalupo; C. Corbu; G. Brambilla. Correlation between induction of DNA fragmentation in urinary bladder cells from rats and humans and tissue-specific carcinogenic activity. Toxicology. 2002, s. 115–128. DOI 10.1016/s0300-483x(02)00354-2. PMID 12204548.
- ↑ K. Sekihashi; A. Yamamoto; Y. Matsumura; S. Ueno; M. Watanabe-Akanuma; F. Kassie; S. Knasmuller. Comparative investigation of multiple organs of mice and rats in the comet assay. Mutation Research. 2002, s. 53–75. DOI 10.1016/s1383-5718(02)00034-7. PMID 12034309.
- ↑ G. Birnier; H. Neumann. Biomonitoring of aromatic amines. II: Haemoglobin binding of some monocyclic aromatic amines. Archives of Toxicology. 1988, s. 110–115. DOI 10.1007/BF00570128. PMID 3196145.
- ↑ P. Eyer. The red cell as a sensitive target for activated toxic arylamines. Arch. Toxicol. Suppl.. 1983, s. 3–12. ISBN 978-3-540-12392-7. DOI 10.1007/978-3-642-69083-9_1. PMID 6578736.
- ↑ S. S. Hecht; K. El-Bayoumy; A. Rivenson; E. Fiala. Bioassay for carcinogenicity of 1,2-dimethyl-4-nitrosobiphenyl, o-nitrosotoluene, nitrosobenzene and the corresponding amines in Syrian golden hamsters. Cancer Letters. 1983, s. 349–354. DOI 10.1016/0304-3835(83)90034-4. PMID 6627231.
- ↑ Hazardous Substances Data Bank (HSDB, online database). [s.l.]: U.S. Department of Health and Human Services, 1997.
- ↑ Patty's Industrial Hygiene and Toxicology. Příprava vydání G. D. Clayton, F. E. Clayton. [s.l.]: John Wiley & Sons, 1981. Dostupné online.
Externí odkazy
 Obrázky, zvuky či videa k tématu o-toluidin na Wikimedia Commons
Obrázky, zvuky či videa k tématu o-toluidin na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Structure of o-Toluidine (2-Methylaniline)









