Octan kobaltnatý
| Octan kobaltnatý | |
|---|---|
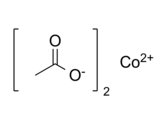 Strukturní vzorec | |
 Vzhled tetrahydrátu | |
| Obecné | |
| Systematický název | ethanoát kobaltnatý |
| Triviální název | octan kobaltnatý |
| Latinský název | cobaltum acetate |
| Anglický název | cobalt(II) acetate |
| Funkční vzorec | (CH3COO)2Co |
| Sumární vzorec | C4H6O4Co |
| Vzhled | rudý prášek růžový (tetrahydrát) |
| Identifikace | |
| Registrační číslo CAS | 71-48-7 6147-53-1 (tetrahydrát) |
| PubChem | 6277 |
| ChEBI | 85138 |
| UN kód | 3XC4P44U7E |
| SMILES | CC(=O)[O-].CC(=O)[O-].[Co+2] |
| InChI | 1S/2C2H4O2.Co/c2*1-2(3)4;/h2*1H3,(H,3,4);/q;;+2/p-2 |
| Číslo RTECS | AG3150000 |
| Vlastnosti | |
| Molární hmotnost | 177,02 g/mol 249,08 g/mol (tetrahydrát) |
| Teplota tání | 140 °C (413 K) (tetrahydrát) |
| Teplota rozkladu | 298 °C |
| Teplota dehydratace | 140 °C (-4 H2O) (tetrahydrát) |
| Hustota | tetrahydrát 1,71 g/cm3 (20 °C/pevné skupenství) [1] |
| Index lomu | 1,542 (tetrahydrát) |
| Rozpustnost ve vodě | tetrahydrát 38 g/100 ml (20 °C) |
| Rozpustnost v polárních rozpouštědlech | 2,1 g/100 mg methanolu (15 °C) rozpustný v alkoholech, zředěných kyselinách |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v pyridinu, amylacetátu (tetrahydrát) |
| Tlak páry | zanedbatelný (20 °C) |
| Měrná magnetická susceptibilita | +11,000·10−6 μm3/g |
| Struktura | |
| Krystalová struktura | jednoklonná (tetrahydrát) |
| Bezpečnost | |
| Nebezpečí | |
| H-věty | H317, H334, H341, H350, H360, H400, H410 [2] |
| P-věty | P261, P272, P273, P280, P281, P284, P302+352, P304+340, P321, P333+313, P391, P405, P501 |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Octan kobaltnatý (též acetát kobaltnatý; systematický název ethanoát kobaltnatý) je organická látka, sůl kyseliny octové a kobaltu. Obvykle se vyskytuje ve formě tetrahydrátu jako Co(CH3COO)2·4 H2O, který je typický svou růžovou barvou.
Vlastnosti
Octan kobaltnatý je za standardní teploty tuhá, krystalická látka. Bezvodá forma má plně červené až rudé zabarvení, oproti tetrahydrátu, který je světle růžový.[2] Octan kobaltnatý má hygroskopické vlastnosti a při déle trvajícímu vystavení vzdušné vlhkosti se rozpouští v krystalové vodě. Látka zapáchá po octu.[2] Jsou známy různé varianty hydrátů této látky, např. Co(CH3COO)2· H2O či [Co(CH3COO)2]5·0.5 H2O.[3]
Příprava
V laboratoři lze připravit například neutralizací hydroxidu kobaltnatého kyselinou octovou.
- CH3COOH + Co(OH)2 → Co(CH3COO)2 + H2O
Další možností výroby, která je používána v průmyslu je neutralizace uhličitanu kobaltnatého kyselinou octovou.
- CH3COOH + CoCO3 → Co(CH3COO)2 + CO2 + H2O
Zdravotní rizika
U této látky, stejně jako u ostatních sloučenin kobaltu, je předpokládána karcinogenita pro člověka, poškození reprodukčních schopností a podezření z mutagenity.[4] Akutní toxicita u krysy při orálním podání byla stanovena na LD50 = 503 mg/kg, což řadí octan kobaltnatý dle WHO mezi látky slabě toxické. Při vdechnutí dochází k podráždění dýchacích cest. Požití způsobuje zvracení, bolesti břicha, bolest a slabost končetin a přítomnost krve ve zvratcích a stolici.[2]
Použití
Bezvodý octan kobaltnatý je v chemickém průmyslu především používán jako katalyzátor. Také je využíván jako prekurzor pro přípravu jiných materiálů, chemických komplexů, mazadel, inkoustů, barviv a v pokovovacích lázních.[5] V barvivech je používán ve formě katalyzátorů přidávaných do nátěrových barev, které urychlují proces zasychání a zrání aplikovaných barev.
Malá množství tetrahydrátu octanu kobaltnatého jsou někdy v chovu hospodářských zvířat přidávána do krmiv pro zlepšení zdravotního stavu dobytka, kde spolu s ostatními solemi kobaltu slouží ke zvýšenému příjmu vitamínu B12. Ten je z těchto solí tvořen v gastrointestinálním traktu především u přežvýkavců za pomoci symbiotických bakterií. Vzhledem k potenciální toxicitě kobaltu v potravinářských výrobcích z takto krmených zvířat, je použití solí kobaltu regulováno.[4]
Reference
- ↑ Cobalt(II) Acetate Tetrahydrate [online]. AMERICAN ELEMENTS ® [cit. 2022-05-21]. Dostupné online. (anglicky)
- ↑ a b c d National Center for Biotechnology Information. Cobalt(II) acetate [online]. PubChem, 2005-07-19, rev. 2022-05-14 [cit. 2022-05-21]. Dostupné online. 6277. (anglicky)
- ↑ ZHANG, Gao; LIN, Jian; GUO, Dong-Wei; YAO, Shi-Yan; TIAN, Yun-Qi. Infinite Coordination Polymers of One- and Two-dimensional Cobalt Acetates. S. 1401–1404. Zeitschrift für anorganische und allgemeine Chemie [online]. Wiley Online Library, 2010 [cit. 2022-05-21]. S. 1401–1404. Dostupné online. ISSN 1521-3749. DOI 10.1002/zaac.200900457. (anglicky)
- ↑ a b EFSA Panel on Additives and Products or Substances used in Animal Feed (FEEDAP) [online]. 7. vyd. Wiley Online Library: EFSA Journal, 2012 [cit. 2022-05-21]. (10). S. 2791. Dostupné online. DOI 10.2903/j.efsa.2012.2791. (anglicky)
- ↑ Chemical Book. Cobalt acetate [online]. [cit. 2022-05-21]. Dostupné online.
Externí odkazy
 Obrázky, zvuky či videa k tématu Octan kobaltnatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Octan kobaltnatý na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Co(CH3COO)2
Autor: Zenista, Licence: CC0
Chemická struktura octanu kobaltnatého v iontové formě









