Octan měďnatý
| Octan měďnatý | |
|---|---|
 Vzhled | |
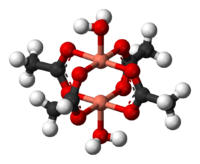 Molekula dihydrátu | |
| Obecné | |
| Systematický název | ethanoát měďnatý |
| Anglický název | copper(II) acetate |
| Sumární vzorec | Cu(CH3COO)2 |
| Identifikace | |
| Registrační číslo CAS | 142-71-2 6046-93-1 (monohydrát) |
| Vlastnosti | |
| Molární hmotnost | 181,63 g/mol (bezvodý) 199,65 g/mol (monohydrát) |
| Teplota tání | 115 °C, 388 K, 239 °F |
| Teplota varu | 240 °C, 513 K, 464 °F |
| Hustota | 1,88 g/cm³ (pevný) |
| Rozpustnost ve vodě | 6,8 g/100 ml (25 °C)[zdroj?] 20 g/100 ml v horké vodě[zdroj?] |
| Rozpustnost v polárních rozpouštědlech | ethanol, mírně rozpustný v glycerolu a etheru. |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Octan měďnatý (též ethanoát měďnatý) je měďnatá sůl kyseliny octové. Jedná se o relativně rozpustnou tmavě modrou látku, které se využívá na výrobu organických sloučenin mědi. Je obsažena i v některých nerostech a je i hlavní látkou jednoho z nich.


Výroba
Měď, na rozdíl od některých jiných kovů, jako je například železo, nereaguje s kyselinami, jelikož měď je podle Beketovovy řady kovů ušlechtilý kov. Proto je výroba poměrně obtížná.
Průmyslově se vyrábí elektrolýzou octanu vápenatého měděnými elektrodami, roztok se nesmí promíchávat, a nakonec se odsaje roztok octanu měďnatého.
Laboratorně lze tuto látku připravit z kyseliny octové a mědi a peroxidu vodíku.
Případně je možno jej připravit z oxidu měďnatého či uhličitanu měďnatého a kyseliny octové
Reakce
Octan měďnatý reaguje s peroxidem vodíku, dochází k rozpadu na nerozpustný oxid měďnatý, proto se musí při výrobě za pomocí peroxidu velice přesně měřit a počítat, avšak při případné chybě lze oxid měďnatý zase nechat zreagovat, viz výše.
Octan měďnatý reaguje s uhličitanem sodným a kyselinou acetylsalicylovou (aspirinem) za vzniku acetylsalicylátu měďnatého, což je nerozpustné modré barvivo.
Z octanu měďnatého lze vyrábět i například dusičnan měďnatý, přičemž vzniká i octan draselný, tyto 2 látky se od sebe poměrně těžko oddělují. Reakce probíhá podle rovnice:
Octan měďnatý se používá na výrobu organických sloučenin mědi, a také jako katalyzátor, například umožňuje hoření cukru.
Reference
- ↑ a b Cupric acetate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Octan měďnatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Octan měďnatý na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Structure of copper(II) acetate dihydrate. Atoms: Cu - pink, O - red, C - black, H - white. Lawrence Que (March 2000) Physical methods in bioinorganic chemistry: spectroscopy and magnetism, University Science Books, pp. 345–348 Retrieved on 22 February 2011. ISBN: 9781891389023.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Copper(II)acetate crystals on electric copper wire.













