Octan sodný
| Octan sodný | |
|---|---|
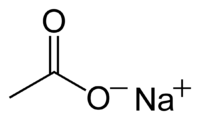 Strukturní vzorec | |
 Vzhled | |
| Obecné | |
| Systematický název | natrium-ethanoát, ethanoát sodný, sodná sůl kyseliny ethanové |
| Triviální název | octan sodný |
| Anglický název | sodium acetate |
| Sumární vzorec | CH3COONa |
| Vzhled | bílá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | (bezvodý) 6131-90-4 (trihydrát)&Units=SI 127-09-3 (bezvodý) 6131-90-4 (trihydrát) |
| Vlastnosti | |
| Molární hmotnost | 82,03 g/mol (bezvodý) 136,08 g/mol (trihydrát) |
| Teplota tání | 58 °C (trihydrát) |
| Hustota | 1,45 g/cm3 (pevný) |
| Disociační konstanta pKb | 9,25 |
| Rozpustnost ve vodě | 76 g/100 ml (0 °C) |
| Bezpečnost | |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Octan sodný je organická látka, sůl kyseliny octové. Jeho vzorec je CH3COONa.
Příprava
Vzniká například reakcí kyseliny octové s hydroxidem sodným (neutralizace).
- NaOH + CH3COOH → CH3COONa + H2O
nebo působením kyseliny octové na soli slabších kyselin. Např. reakcí s hydrogenuhličitanem sodným vzniká octan sodný a uvolněná kyselina uhličitá se okamžitě rozkládá na vodu a oxid uhličitý:
- CH3COOH + NaHCO3 → CH3COONa + H2O + CO2
Vlastnosti a použití
Octan sodný je označován také jako E 262. Používá se jako katalyzátor a v potravinářství především jako regulátor kyselosti.
V chemii se používá pro přípravu některých pufrů.[1]
Pokud krystaly trihydrátu octanu sodného zahřejeme nad 58 °C, vznikne kapalina. Po jejím vychlazení zpět na teplotu cca 15 °C a vzniku krystalizačního jádra (např. dotykem) začne docházet opět ke krystalizaci na pevné skupenství. Při této reakci se uvolňuje teplo, odtud se vzal název „horký led“. Této vlastnosti se využívá v hřejivých polštářcích (podobně jako též thiosíran sodný).[2]

Díky této vlastnosti se dá vytvářet mnoho různých obrazců, které vypadají jako krápníky v jeskyních – když jej lijeme na sklo (může to být jakýkoliv jiný materiál), začne rychle krystalizovat a krystaly se lepí na sebe („rostou“ do výšky). Krystalizace octanu sodného se používá jako ohřívadlo – přesycený roztok octanu sodného je uzavřen v pevném sáčku spolu s vroubkovanou vypouklou kovovou destičkou. Když se destička prohne, do roztoku se z ní uvolní mikrokrystaly, které se stanou nukleačními jádry a roztok díky své přesycenosti začne krystalizovat. Vzniká hydratovaná sůl (trihydrát octanu sodného, CH3COONa·3H2O) a uvolňuje se teplo z krystalové mřížky. Toto použití kovové destičky bylo vynalezeno v roce 1978.
Skupenské teplo tání trihydrátu je 264-289 kJ/kg.[3]
Dekrystalizace pro opětovné použití je možná ponořením sáčku do vřící vody na 10-15 minut, kdy dojde k rozpuštění krystalů a obnově přesyceného roztoku. Před dalším použitím je vhodné počkat na zchladnutí sáčku na pokojovou teplotu, jelikož použití nezchladnutého sáčku snižuje oproti zchlazenému maximální teplotu dosaženou v dalším cyklu.[zdroj?]
Reference
- ↑ Acetate Buffer (pH 3.6 to 5.6) Preparation and Recipe | AAT Bioquest. www.aatbio.com [online]. [cit. 2023-03-03]. Dostupné online.
- ↑ Záhada samoohřívacího polštářku. Dvojka [online]. 2017-02-14 [cit. 2023-03-03]. Dostupné online.
- ↑ Ibrahim Dincer and Marc A. Rosen. Thermal Energy Storage: Systems and Applications, page 155
Externí odkazy
 Obrázky, zvuky či videa k tématu Octan sodný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Octan sodný na Wikimedia Commons
Média použitá na této stránce
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Hand warmer with scale
Autor: Milda 444, Licence: CC BY-SA 4.0
Octan sodný; Fotografováno na SPŠCHBR




