Odstupující skupina
Odstupující skupina[1] (odcházející skupina[zdroj?!]) je v chemii část molekuly, která se odpojuje společně s dvojicí elektronů při heterolytickém štěpení vazby. Může jít o anion, kation i neutrální částici, podstatné je, že tato skupina stabilizuje zvýšenou elektronovou hustotu vytvořenou při rozštěpení vazby. Častými odstupujícími skupinami jsou halogenidové anionty (Cl−, Br− a I−) a sulfonátové estery, například tosyláty (TsO−). Fluoridové ionty (F−) jsou odstupující skupinou u sarinu. Z neutrálních molekul nejčastěji jako odstupující skupiny fungují voda a amoniak (NH3). Kladně nabitou odstupující skupinou může být například vodíkový kation (H+) při nitraci benzenu.[2][3]
Síly odstupujících skupin
Síla odstupující skupiny je určena rychlostí probíhající reakce, Lepší odstupující skupiny reagují rychleji. Podle teorie přechodného stavu mají dobré odstupující skupiny nízké aktivační bariéry, což vede k tvorbě stabilnějších přechodných stavů.
Síla odstupujících skupin se nejčastěji využívá při zkoumání SN1 a E1 reakcí, zahrnujících aniontové odstupující skupiny, lze ji však využít u jakékoliv reakce, ve kterých se objevují odstupující skupiny. Dobré odstupující skupiny mají větší záporný náboj než výchozí látky a tak musí být schopny tento náboj stabilizovat, například tvorbou stabilních aniontů. K porovnávání stability aniontů se používá pKa konjugované kyseliny, lepší odstupující skupiny mívají nižší pKaH.

Závislost reaktivity odstupující skupiny na pKaH není vždy takto jednoduchá. Reaktivita záleží na rozdílu energie výchozích látek a přechodného stavu (ΔG‡) a rozdílná reaktivita různých skupin odpovídá odlišným hodnotám změny této energie (ΔΔG‡). Hodnota pKaH však spíše odpovídá rozdílu energií výchozích látek a produktů (ΔG) a rozdílná kyselost má vliv na změnu tohoto rozdílu (ΔΔG). Při srovnávání pKa se uvažuje, že je odstupující skupina v reaktantu navázána na proton, zatímco při srovnávání reaktivity je (obvykle) navázána na uhlík. Silné zásady, jako například OH−, OR− a NR2−, vytvářejí špatné odstupující skupiny, protože nemohou stabilizovat záporný náboj.
| odstupující skupiny seřazené podle reaktivity[4] | |
|---|---|
| R-N2+ | didusík |
| R-OR'2+ | dialkylethery |
| R-OSO2RF | perfluoralkylsulfonáty (například trifláty) |
| R-OTs, R-OMs, etc. | tosyláty a mesyláty |
| R-I | jodidy |
| R-Br | bromidy |
| R-OH2+, R'-OHR+ | voda, alkoholy |
| R-Cl | chloridy |
| R-ONO2, R-OPO(OH)2 | dusičnany, fosforečnany a další estery anorganických kyselin |
| R-SR'2+ | thioethery |
| R-NR'3+, R-NH3+ | aminy, amoniak |
| R-F | fluoridy |
| R-OCOR | karboxyláty |
| R-OAr | fenoxidy |
| R-OH, R-OR | hydroxidy, alkoxidy |
| R-NR2 | amidy |
Hydridové a alkylové ionty se prakticky neobjevují jako odstupující skupiny, protože příslušné zásady jsou nestabilní.
Aktivace
Při E1 a SN1 reakcích často lze špatnou odstupující skupinu přeměnit na lepší protonací nebo komplexací pomocí Lewisovy kyseliny. Takto lze molekuly zbavit špatných odstupujících skupin, například hydroxidové.
Podobný jev se vyskytuje u Friedelových–Craftsových reakcí, kde je potřeba silná Lewisova kyselina k tvorbě karbokationtu z alkylhalogenidu při alkylaci a nebo acyliového iontu z acylhalogenidu.

Při reakcích zahrnujících aktivaci odstupující skupiny se kation většinou vytváří v samostatném kroku, předtím než dojde k nukleofilnímu ataku nebo eliminaci. Například SN1 a E1 reakce mají takový krok, zatímco SN2 a E2 reakce nikoliv.
Eliminace konjugovaných zásad
Při eliminacích konjugovaných zásad dochází k oddělení odstupující skupiny z polohy β na molekule enolu a obnovení karbonylové struktury z čtyřstěnného meziproduktu při nukleofilní acylové substituci. Za vhodných podmínek může i u amidů proběhnout zásaditá hydrolýza, při které se odštěpuje špatná odstupující skupina R2N−. Benzoátové anionty lze dekarboxylovat zahříváním s mědí nebo oxidem měďnatým, přičemž dochází k oddělení arylového aniontu. Reakci umožňuje vznik arylměďnaté sloučeniny, která je lepší odstupující skupinou než zásaditější sůl alkalického kovu. K těmto jevům dochází při tvorbě vazby C=O, která usnadňuje jinak obtížně proveditelné reakce. Dobrá odstupující skupina příliš není potřeba při vzniku vazby C=C E1cB mechanismem, ovšem vzhledem k poměrně slabé vazbě C=C je i tato reakce poněkud citlivá na sílu odstupující skupiny. Změna odstupující skupiny může ovlivnit mechanismus eliminační reakce. U slabých odstupujících skupin převládá E1cB mechanismus, avšak při použití silnějších bude mít převahu tvorba karboaniontu B z TS BC‡, přičemž rychlost reakce bude určovat deprotonace probíhající přes TS AB‡ soustředěným E2 mechanismem. V takovém případě se odstupující skupina stává dostatečně silnou na to, aby přechodný stav mezi meziprodukty B a C měl nižší energii než B. Protože vzniká pouze jeden přechodný stav mezi výchozí látkou A a produktem C, tak reakce probíhá kvůli oslabení odstupující skupiny soustředěným mechanismem.
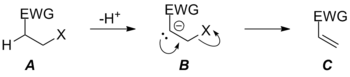

Super a hyper odstupující skupiny
Příkladem „super“ odstupující skupiny je triflátový anion; označení se používá i pro jiné podobně dobré odstupující skupiny. Sloučeniny, u kterých dochází k oddělení super odstupující skupiny za tvorby stabilního karboaniontu jsou obvykle velmi reaktivní a tedy nestabilní. Nejčastěji používanými organickými trifláty jsou tak methyl-triflát, alkenyl- a aryltrifláty, které nemohou vytvářet stabilní karbokationty. Steroidní alkylnonafláty (které také mají super odstupující skupinu) odvozené od alkoholů a perfluorbutansulfonylfluoridu nelze izolovat, protože rychle vstupují do eliminačních i substitučních reakcí kvůli tvorbě fluoridových iontů. Smíšené acyl-trifluormethansulfonylanhydridy lze použít k Friedelovým-Craftsovým acylacím i bez přítomnosti katalyzátoru,[5] zatímco při použití acylhalogenidu by byla potřeba katalýza silnou Lewisovou kyselinou. Methyltriflát ovšem nelze použít k alcylacím aromatických substrátů se střední elektronovou hustotou.
Ještě reaktivnější než „super“ jsou „hyper“ odstupující skupiny. Patří k nim mimo jiné deriváty λ3-jodanu, například diaryljodoniové soli a další haloniové ionty. V jedné studii byla porovnávána reaktivita různých odstupujících skupin, relativní reaktivita oproti chloridům (krel=1) stoupala přes bromidy (krel=14), jodidy (krel=91), tosyláty (krel=3,7 x 104) a trifláty (krel=1,4 x 108) k tetrafluorboritanu fenyljodonia (C6H5I+ BF4−, krel=1,2 x 1014) Za hyper odstupující skupiny jsou považovány ty, které reagují rychleji než trifláty a mohou se účastnit redukčních eliminací. U haloniových iontů může jít o redukci haloniovýcjh iontů na halogenidy za uvolnění aniontu. Vysoká reaktivita sloučenin obsahujících hyper odstupující skupiny je částečně způsobována entropickou výhodností rozdělení jedné molekuly na tři.

Byly také popsány dialkylhaloniové ionty; sloučeniny, které je obsahují, i přesto, že velmi snadno reagují s nukleofily, mohou být připraveny jako pevné soli s velmi slabě nukleofilními ionty, jako jsou SbF -
6 [6][7] a CHB11Cl -
11 .[8] Výrazná elektrofilita těchto skupin usnadňuje jejich reakce s nestabilními alkylhalogenidovými odstupujícími skupinami a projevuje se například těm, že mohou alkylovat velmi slabě nukleofilní karboranový anion za odštěpení CH3Cl jako odstupující skupiny. Kombinace silně elektrofilních vlastností s nestabilitou primárních karbokationtů vytvářených ionizací jejich alkylových skupin, jim umožňuje podílet se na Friedelových-Craftových alkylacích.[6] Reaktivita těchto skupin klesá v řadě R-I < R-Br < R-Cl.
Odkazy
Související články
Reference
V tomto článku byl použit překlad textu z článku Leaving group na anglické Wikipedii.
- ↑ MCMURRY, John. Organická chemie. [s.l.]: [s.n.], 2007. ISBN 978-80-7080-637-1. S. 353. Český překlad.
- ↑ Gold Book: leaving group. [s.l.]: IUPAC, 2009. Dostupné v archivu pořízeném dne 2017-11-07. ISBN 978-0-9678550-9-7. doi:10.1351/goldbook.L03493. Kapitola Leaving group. Archivováno 7. 11. 2017 na Wayback Machine.
- ↑ Gold Book: electrofuge. [s.l.]: IUPAC ISBN 978-0-9678550-9-7. doi:10.1351/goldbook.L03493.
- ↑ Smith, March. Advanced Organic Chemistry 6th ed. (501-502)
- ↑ A. Garcia Martínez; A. Herrera Fernandez; D. Molero Vilchez; M. L. Laorden Gutiérrez; L. R. Subramanian. New Easy One-Step Synthesis of Isoquinoline Derivatives from Substituted Phenylacetic Esters. Synlett. 1993, s. 229–230. ISSN 0936-5214. doi:10.1055/s-1993-22413.
- ↑ a b George A. Olah; John R. DeMember. Friedel-Crafts chemistry. IV. Dialkylhalonium ions and their possible role in Friedel-Crafts reactions. Journal of the American Chemical Society. 1969, s. 2113–2115. ISSN 0002-7863. doi:10.1021/ja01036a044.
- ↑ George A. Olah; John R. DeMember. Friedel-Crafts chemistry. V. Isolation, carbon-13 nuclear magnetic resonance, and laser Raman spectroscopic study of dimethylhalonium fluoroantimonates. Journal of the American Chemical Society. 1970, s. 718–720. ISSN 0002-7863. doi:10.1021/ja00706a058.
- ↑ Evgenii S. Stoyanov; Irina V. Stoyanova; Fook S. Tham. Dialkyl Chloronium Ions. Journal of the American Chemical Society. 2010, s. 4062–4063. ISSN 0002-7863. doi:10.1021/ja100297b. PMID 20218556.
Média použitá na této stránce
Autor: Cseizert, Licence: CC BY-SA 3.0
Reductive elimination of lamda-3 iodanes
Autor: Cseizert, Licence: CC BY-SA 3.0
Continuum from E1cB to E2 eliminations
Autor: Cseizert, Licence: CC BY-SA 3.0
Ionization or first step in SN1/E1 reaction
Autor: Cseizert, Licence: CC BY-SA 3.0
Friedel Crafts mechanism with AlCl3 catalyst




