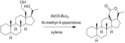Oppenauerova oxidace
Oppenauerova oxidace je organická reakce, kterou vyvinul Rupert Viktor Oppenauer[1] jako způsob selektivní oxidace sekundárních alkoholů na ketony.

Reakce je opakem Meerweinovy–Ponndorfovy–Verleyovy redukce.[2] Alkohol je oxidován isopropoxidem hlinitým za přítomnosti nadbytku acetonu, který posouvá rovnováhu ve prospěch produktů.
Tato oxidace má vysokou selektivitu vůči sekundárním alkoholům a neoxiduje ostatní citlivé funkční skupiny, jako jsou například aminy a thioethery.[3]
I když lze tímto způsobem oxidovat i primární alkoholy, tak se u nich téměř nepoužívá, protože současně s oxidací alkoholu probíhají aldolové kondenzace vznikajících aldehydů; Oppenauerova oxidace je však i tak používána u substrátů citlivých na kyseliny. Z velké části byla nahrazena metodami založenými na chromanech, jako jsou chlorchroman pyridinia, nebo na dimethylsulfoxidu (například Swernova oxidace), případně Dessově–Martinově perjodinanu, kdy se používají poměrně netoxická činidla. Oppenauerova oxidace je častou složkou průmyslových procesů, například v rámci výroby steroidů, hormonů, alkaloidů a terpenů.
Mechanismus
V prvním kroku se alkohol (1) naváže na hliník za tvorby komplexu (3), který je ve druhém kroku deprotonován alkoxidem (4) na meziprodukt (5). Dále se na hliník navážou aceton i substrát (7). Koordinace acetonu s hliníkem jej aktivuje vůči přesunu hydridu z alkoxidu. Proběhne přesun hydridového iontu, katalyzovaný hliníkem, z α-uhlíku alkoholu na karbonylový uhlík acetonu přes šestičlenný přechodný stav (8), po němž se utvoří keton (9).[4]
Výhody
Výhodou Oppenauerovy oxidace je použití poměrně nenákladných a netoxických výchozích látek. Reakční podmínky jsou mírné, jelikož se substráty zahřívají ve směsích acetonu a benzenu. Další vlastností Oppenauerovy oxidace, která ji odlišuje od ostatních metod, jako jsou použití chlorchromanu pyridinia a Dessova–Martinova oxidace, je mnohem rychlejší oxidace sekundárních alkoholů než primárních a z toho vznikající chemoselektivita. Také při ní nedochází k přeoxidování aldehydů na karboxylové kyseliny, jako například u Jonesovy oxidace.[4]
Obměny
Wettsteinova-Oppenauerova reakce
Při Wettsteinových-Oppenauerových reakcích jsou oxidovány Δ 5–3β-hydroxysteroidy na Δ 4,6-3-ketosteroidy, akceptorem hydridových iotů je benzochinon. Tímto způsobem lze získat Δ 4,6-3-ketosteroidy v jediném kroku.[5]
Woodwardova varianta
Woodwardova varianta, také nazývaná Oppenauerova–Woodwardova oxidace, spočívá v nahrazení hlinitého alkoxidu terc-butoxidem draselným. Používá se tehdy, když se alkoholové skupiny neoxidují za podmnínek běžné Oppenauerovy reakce; například terc-butoxid draselný a benzofenon mohou zoxidovat chinin na chininon, což u katalytického systému založeného na hliníku nelze z důvodu tvorby komplexu koordinací Lewisovsky zásaditého dusíku na hliník.[6]
Ostatní varianty
Bylo posáno několik upravených alkoxidových katalyzátorů, jeden z nich byl použit na přeměnu karveolu na izoprenoid karvon s výtěžností 94 %.[7]
V další variantě[8] byl katalyzátorem trimethylhliník a aldehydem 3-nitrobenzaldehyd, tato kombinace sloužila k oxidaci isoborneolu na kafr.
Syntetická využití
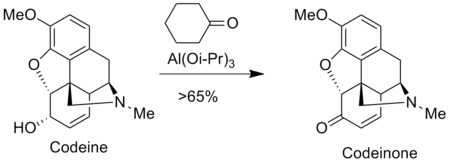
Oppenauerova oxidace se používá při výrobě analgetik, jako jsou morfin a kodein, například kodeinon se získává Oppenauerovou oxidací kodeinu.[9]
Oppenauerovy oxidace jsou také zahrnuty do syntéz hormonů; například progesteron se takto vyrábí z pregnenolonu.[10]
Mírně upravenou Oppenauerovu oxidaci lze také použít k přípravě derivátů steroidů, například varianta katalyzovaná rutheniovým katalyzátorem může sloužit k oxidaci 5-nenasycených 3β-hydroxysteroid]ů na odpovídající 4-en-3-onové sloučeniny.[11]
Tato reakce může být též použita na tvorbu katonů z 1,4- a 1,5 diolů.[12]
Vedlejší reakce
Společně s Oppenauerovou oxidací často probíhá aldolová kondenzace aldehydového produktu, pokud má α-vodíky, za vzniku β-hydroxyaldehydů nebo α, ß-nenasycených aldehydů.[13]
Další vedlejší reakce jsou Tiščenkovy reakce aldehydů bez α-vodíků, kterým ovšem lze zabránit použitím bezvodých rozpouštědel.[4] Dalším případem může být přesun dvojné vazby při oxidacích allylalkoholových substrátů.[14]
![Oppenauerova oxidace steroidu[14]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/36/Wiki-oppenaure-mxa2.tif/lossy-page1-350px-Wiki-oppenaure-mxa2.tif.jpg)
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Oppenauer oxidation na anglické Wikipedii.
- ↑ R. V. Oppenauer. Eine Methode der Dehydrierung von Sekundären Alkoholen zu Ketonen. I. Zur Herstellung von Sterinketonen und Sexualhormonen. Recueil des Travaux Chimiques des Pays-Bas. 1937, s. 137–144. doi:10.1002/recl.19370560206.
- ↑ A. L. Wilds. Reduction with Aluminum Alkoxides (The Meerwein-Ponndorf-Verley Reduction). Organic Reactions. 1944, s. 178–223. doi:10.1002/0471264180.or002.05.
- ↑ L. Otvos; L. Gruber; J. Meisel-Agoston. The Meerwein-Ponndorf-Verley-Oppenauer. Investigation of the reaction mechanism with radiocarbon. Racemization of secondary alcohols. Acta chimica Academiae Scientiarum Hungaricae. 1965, s. 149–153. doi:10.1002/0471264180.or002.05.
- ↑ a b c E. J. Corey. Strategic Applications of Named Reactions in Organic Synthesis. [s.l.]: Elsevier, 2005. ISBN 978-7-03-019190-8.
- ↑ L. Mandell. The Mechanism of the Wettstein-Oppenauer Oxidation. Journal of the American Chemical Society. 1955, s. 3199–3201. doi:10.1021/ja01594a061.
- ↑ R. B. Woodward; N. L. Wendler; J. F. Brutschy. Quininone1. Journal of the American Chemical Society. 1945, s. 1425. doi:10.1021/ja01225a001.
- ↑ T. Ooi; H. Otsuka; T. Miura; H. Ichikawa; K. Maruoka. Practical Oppenauer (OPP) oxidation of alcohols with a modified aluminum catalyst. Organic Letters. 2002, s. 2669–2672. doi:10.1021/ol020094c. PMID 12153205.
- ↑ C. R. Graves; B. S. Zeng; S. T. Nguyen. Efficient and Selective Al-Catalyzed Alcohol Oxidation via Oppenauer Chemistry. Journal of the American Chemical Society. 2006, s. 12 596 – 12 597. doi:10.1021/ja063842s.
- ↑ Stéphane Caron; Robert W. Dugger; Sally Gut Ruggeri; John A. Ragan; David H. Brown Ripin. Large-Scale Oxidations in the Pharmaceutical Industry. Chemical Reviews. 2006, s. 2943–2989. doi:10.1021/cr040679f. PMID 16836305.
- ↑ P. Dewick. Medicinal Natural Products: A Biosynthetic Approach. [s.l.]: John Wiley & Sons, 2001. ISBN 0471496405. S. 243.
- ↑ L. S. Maria; Paval Kočovský; Jan-E. Bäckvall. Ruthenium-Catalyzed Oppenauer-Type Oxidation of 3β-Hydroxy Steroids. A Highly Efficient Entry into the Steroidal Hormones with 4-En-3-one Functionality. The Journal of Organic Chemistry. 1996, s. 6587–6590. doi:10.1021/jo960361q. PMID 1166752.
- ↑ L. Eignerova; A. Kasal. Intramolecular hydride shift in Oppenauer oxidation of some dihydroxy steroids. ChemPlusChem. 1976, s. 1056–1065. doi:10.1135/cccc19761056.
- ↑ N. A. Milas; F. X. Grossi; S. E. Penner; S. Kahn. The Synthesis of 1-[cyclohexen-1'-yl]-3-Methyl-1,3,5-Octatrien-7-One (C15Ketone)1. Journal of the American Chemical Society. 1948, s. 1292. doi:10.1021/ja01183a522.
- ↑ a b R. Reich; J. F. W. Keana. Oppenauer Oxidations Using 1-Methyl-4-Piperidone as the Hydride Acceptor. Synthetic Communications. 1972, s. 323. doi:10.1080/00397917208061988.
Související články
- Oxidace alkoholů
- Jonesova oxidace
- Pfitznerova–Moffattova oxidace
- Parikhova–Doeringova oxidace
- Albrightova–Goldmanova oxidace
- Swernova oxidace
- Coreyova–Kimova oxidace
- Leyova oxidace (oxidace ruthenistanem tetrapropylamonným)
- Dessova–Martinova oxidace (oxidace Dessovým–Martinovým perjodinanem)
- Oxidace pomocí TEMPO
- Chlorchroman pyridinia
Externí odkazy
 Obrázky, zvuky či videa k tématu Oppenauerova oxidace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Oppenauerova oxidace na Wikimedia Commons
Média použitá na této stránce
Autor: Mxa2, Licence: CC BY-SA 3.0
oppenauer oxidation of a steroid derivative. Synth Commun 1972, 323-325
Oppenauer oxidation reaction scheme
Autor: Lankaluf, Licence: CC BY-SA 3.0
oppenauer oxidation mechanism
Autor: Lankaluf, Licence: CC BY-SA 3.0
wettstein oppenauer reaction