Organická chemie

Organická chemie je vědním oborem chemie, který se zabývá strukturou, vlastnostmi, přípravou, reakcemi a využitím organických sloučenin, které obsahují uhlík v kovalentní vazbě. Organická chemie se nezabývá jednoduchými sloučeninami uhlíku (například oxid uhelnatý CO, oxid uhličitý CO2, uhličitan vápenatý CaCO3, kyanovodík HCN, sirouhlík CS2, kyselina kyanatá a její soli kyanatany, kyselina izokyanatá a její soli izokyanatany). Tyto jednoduché sloučeniny uhlíku popisuje anorganická chemie.
Uhlík má mezi ostatními prvky unikátní postavení. Ve své valenční vrstvě má 4 elektrony a může vytvářet silné kovalentní vazby. Tato čtyřvaznost uhlíku se odvozuje od excitované elektronové konfigurace (v základním stavu by atom uhlíku byl pouze dvojvazný). Navíc se mohou uhlíkové atomy navzájem spojovat a tvořit dlouhé řetězce nebo kruhy. Tomuto jevu se říká řetězení atomu uhlíku.
Uhlík jako jediný ze všech prvků dokáže tvořit jak jednoduché sloučeniny (například methan CH4, oxid uhelnatý CO, oxid uhličitý CO2), tak velmi složité (například bílkoviny nebo DNA s desítkami miliard atomů uhlíku).

Počet organických sloučenin je obrovský. Zahrnuje uhlovodíky (sloučeniny obsahující pouze uhlík a vodík) a také sloučeniny obsahující kromě uhlíku další prvky (například kyslík, dusík, síru, fosfor, halogeny). Chemická struktura a funkční skupiny organických sloučenin jsou základem pro rozmanitost organických molekul, které jsou obsaženy v rostlinách a živočiších (cukry, tuky, bílkoviny, nukleové kyseliny a další sloučeniny). Organické sloučeniny tak tvoří základ veškerého života na Zemi.
Organická chemie je v současnosti schopna syntetizovat některé organické přírodní látky (například sacharidy, peptidy, přírodní barviva, alkaloidy, vitamíny), ale i organické látky v přírodě se nevyskytující (například plasty, drogy, pesticidy, syntetická vlákna). Vývoj v organické chemii měl za posledních 150 let významný dopad na lidské zdraví, výživu, oblečení a rozmanitost spotřebního zboží.
Historie organické chemie
- Původně se tato věda zabývala studiem látek z oblasti živé přírody. Vznikla na přelomu 18. a 19. století jako samostatný vědní obor v souvislosti s rozdělením přírody na neživou (anorganickou) a živou (organickou).
- Významnou zásluhu na tom měl švédský chemik Carl Wilhelm Scheele, který izoloval organické látky z přírodních zdrojů (například kyselinu vinnou a citronovou).
- Lomonosov a Lavoisier při studiu procesu hoření prokázali, že základ všech sloučenin živočišného a rostlinného původu je uhlík a vodík.
- Dlouhou dobu vládla vitalistická teorie založena zejména Berzeliem, který žil na přelomu osmnáctého století. Podle ní všechny látky vznikají v organismech působením živé síly (vitalis).
- Tuto teorii popřel Friedrich Wöhler, když v roce 1828 zahříváním anorganické sloučeniny (kyanatan amonný) připravil sloučeninu organickou (močovinu).
- Proto byla definice organické chemie zpřesněna a platí dodnes. Říká, že je to chemie zabývající se sloučeninami uhlíku kromě oxidu uhelnatého, oxidu uhličitého, kyseliny uhličité, kyanovodíku, kyseliny kyanovodíkové, kyseliny kyanaté, kyseliny thiokyanaté, kyanidů, kyanatanů, thiokyanatanů, uhličitanů a karbidů.
- Prudký rozmach organické chemie nastal ve druhé polovině 19. století, kdy bylo objeveno mnoho organických sloučenin. Především díky schopnosti atomů uhlíku tvořit různě dlouhé a rozvětvené řetězce je tento počet velmi vysoký.
- V dnešní době platí názor, že chemie je jen jedna. Stejné principy a zákonitosti, které objasňují chování nejjednodušších anorganických sloučenin platí i pro nejsložitější organické sloučeniny. Nicméně dělení na anorganickou a organickou chemii, které vzniklo historickým vývojem, se ukazuje z hlediska studia chemie jako velmi praktické.
Strukturní teorie
Na strukturní teorii, která popisuje základní pravidla stavby organických sloučenin, se podíleli Butlerov, Kekulé a Couper. Základní pravidla jsou tato:
- Atomy uhlíku mají ve vnější elektronové slupce čtyři valenční elektrony.
- Každý atom uhlíku je čtyřvazný, neboť jeho čtyři valenční elektrony mají snahu vytvořit čtyři kovalentní vazby s valenčními elektrony jiných atomů.
- Atomy uhlíku se mohou mezi sebou vázat vazbou jednoduchou, dvojnou nebo trojnou.
- Všechny vazby jsou navzájem rovnocenné (jsou stejně dlouhé).
- Vazebné elektronové páry kovalentní vazby jsou znázorňovány čárkou mezi chemickými značkami atomů, například C–C.
- Uhlíkové řetězce mohou být lineární, větvené nebo cyklické. Mohou být spojeny neuhlíkovými vazebnými elektrony s vodíkem a dalšími prvky (zejména kyslíkem, dusíkem, sírou, fosforem). Tak se mohou vytvářet velké až velmi velké molekuly (polymery, makromolekuly). Existuje také mnoho izomerů organických sloučenin, což jsou sloučeniny se stejným celkovým složením (molekulární vzorec), ale odlišnou strukturou (strukturní vzorec).
Základní dělení organických sloučenin

Alifatické uhlovodíky
Alifatické uhlovodíky se dělí do tří skupin podle stavu nasycení:
- alkany (parafiny) - pouze jednoduché vazby C-C, C-H
- alkeny (olefiny) - obsahují jednu nebo více dvojných vazeb
- alkyny (acetyleny) - obsahují jednu nebo více trojných vazeb

Vzorec benzenu
Aromatické uhlovodíky
Aromatické uhlovodíky jsou cyklické uhlovodíky, které obsahují konjugované dvojné vazby. Jednou z nejznámějších aromatických sloučenin je benzen, protože je jednou z nejjednodušších a nejstabilnějších aromatických látek.
Funkční (charakteristické) skupiny
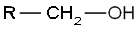
Organické sloučeniny jsou klasifikovány také podle funkčních skupin (například alkoholy, karboxylové kyseliny, aminy, nitrily, karbonylové sloučeniny a další). Reaktivita funkční skupiny je v různých molekulách téměř stejná a má rozhodující vliv na chemické a fyzikální vlastnosti organických sloučenin. Většina funkčních skupin obsahuje atomy jiné než uhlík C a vodík H.
Heterocyklické uhlovodíky

Heterocyklické uhlovodíky obsahují i jiné atomy (heteroatomy) než uhlík C a vodík H. Heteroatomem je například kyslík O, dusík N, síra S, fosfor P, atd. Mohou existovat buď jako substituenty připojené externě ke kruhu (exocyklické), nebo jako člen samotného kruhu (endocyklické). Heteroatom heterocyklických molekul je nejčastěji kyslík, síra nebo dusík, přičemž dusík je obzvláště běžný v biochemických systémech. Heterocykly převládají v mnoha biochemických sloučeninách, jako jsou například alkaloidy, vitamíny, steroidy a nukleové kyseliny (DNA, RNA).
Polymery
Polymery jsou makromolekuly vytvořené spojením mnoha molekul jednoho nebo více druhů atomů. Nejčastěji jsou tvořeny právě uhlíkovými řetězci. Proces spojování se nazývá polymerace, zatímco řetězce nebo sítě se nazývají polymery. Zdrojová sloučenina se nazývá monomer.
Existují dvě hlavní skupiny polymerů, syntetické polymery a biopolymery. Syntetické polymery jsou uměle vyráběny a jsou běžně označovány jako průmyslové polymery. Biopolymery se vytvářejí a vyskytují v živých organismech.
Zdroje organických látek
Ze všech sloučenin, které existují na Zemi, je pouze 4 % anorganických sloučenin a naopak 96 % organických sloučenin. Dá se říct, že zdroje organických sloučenin jsou prakticky nevyčerpatelné. Jejich výrobu můžeme rozdělit podle zdrojů:
- z anorganických sloučenin
- z organických sloučenin:
- fosilní (minulé) zdroje – ropa, uhlí, zemní plyn, rašelina, dřevo
- recentní (současné) zdroje – rostlinné a živočišné organismy
Význam organických sloučenin
Téměř v každém zboží naší každodenní potřeby jsou přítomny organické látky:
- Potraviny
- Léčiva
- Plasty
- Syntetická vlákna
- Čisticí prostředky od jednoduchých mýdel až po složité povrchově aktivní látky pro speciální aplikace
- Barviva v knihách, časopisech a dalších tiskovinách
- Fosilní paliva - uhlí, ropa, zemní plyn, dřevo
- Nátěrové barvy
- Pesticidy
- Výbušniny
- Bojové chemické látky (yperit, sarin, fosgen)
Reference
V tomto článku byly použity překlady textů z článků Organic chemistry na anglické Wikipedii a Organische Chemie na německé Wikipedii.
Literatura
SVOBODA JIŘÍ A KOL. Organická chemie I, 1. vydání [online]. VŠCHT v Praze, 2005 (2007 dotisk). Dostupné online. ISBN 978-80-7080-561-9.
Externí odkazy
 Obrázky, zvuky či videa k tématu organická chemie na Wikimedia Commons
Obrázky, zvuky či videa k tématu organická chemie na Wikimedia Commons - (anglicky) IUPAC Blue Book "Nomenclature of Organic Chemistry", Version 2, IUPAC, 1. duben 2022 – aktuální verze názvosloví organické chemie






