Organická fotochemie
Organická fotochemie je obor organické chemie a fotochemie zkoumající organické reakce spouštěné působením světla;[1][2] tyto reakce často vyvolává pohlcování ultrafialového záření organickými molekulami. V organické fotochemii se nejdříve využívalo viditelné světlo, zatímco později převládlo používání ultrafialových lamp. Organické fotochemické reakce se používají na jednoduché vytváření složitých organických molekul.
Historie
První případy organofotochemických reakcí, které spočívaly v tvorbě sraženin nebo změnách barvy při vystavení vzorků slunečnímu světlu, nebyly často zachyceny. Prvním popsanou organofotochemickou reakcí byla přeměna santoninu na žlutou sloučeninu pomocí slunečního světla:[3]

Jedním z prvních příkladů fotochemické tvorby sraženiny byla fotodimerizace antracenu.[4] Podobně se podařilo dimerizovat kyselinu skořicovou na kyselinu truxilovou. Nyní je známo mnoho dalších fotodimerů, například pyrimidinu, thiofosgenu a diamantanu.
V roce 1956 byla provedena reakce, při které proběhla fotolýza nitroskupiny v poloze meta namísto obvyklé aktivace v polohách ortho a para.[5]

Pokrok v organické fotochemii přinesla Woodwardova–Hoffmannova pravidla.[6][7] Tato pravidla pomohla vysvětlit výsledek fotochemicky řízené elektrocyklického uzavírání kruhu hexa-2,4-dienu, které probíhá disrotačně.

Organické reakce vyhovující těmto pravidlům se označují jako symetricky povolené. Reakce probíhající opačně jsou symetricky zakázané a buď vyžadují mnohem více energie, nebo vůbec neprobíhají.
Příklady reakcí
Organické fotochemické reakce se vysvětlují pomocí excitovaných stavů.[8][9]
Podobně jako u struktury byl zkoumán také vliv násobnosti spinových stavů - zda jde o singlety nebo triplety - na reaktivitu. Triplety mívají delší životnosti a nižší energie než singlety o stejné konfiguraci. Triplety mohou vznikat z vytvořených singletů nebo interakcemi s triplety o vyšších energiích.
K běžným organickým fotochemickým reakcím patří: Norrishovy reakce (dělené na typy I a II), racemizace opticky aktivních bifenylů, cyklohexadienonové přesmyky (mohou být typu A nebo B), di-pí-methanové přesmyky, přesmyky bicyklo[3.1.0]hexanonů na fenoly, fotochemické elektrocyklické procesy, přesmyky epoxyketonů na beta-diketony, otevírání kruhu u cyklopropylketonů, heterolýzy 3,5-dimethoxylbenzylových sloučenin, a fotochemické cyklizace dienů.
Přehled

Reaktanty fotochemických reakcí mohou být plynné i kapalné.[10] Zpravidla se reagující látky musí dostat do blízkosti zdroje světla, aby bylo dosaženo nejvyšší možné světelné účinnosti. Reakční směs tak může být ozářena buď přímo, nebo ze strany reaktoru.[11]
Nevýhodou fotochemických reakcí je nízká účinnost přeměny elektrické energie na energii záření o potřebné vlnové délce. Zdroj záření vydává také velké množství tepla, což způsobuje nutnost chlazení. Většina zdrojů vyzařuje polychromatické záření, potřeba je však monochromatické.[12] Tyto nevýhody jsou vyvažovány vysokým kvantovým výtěžkem.
Tyto reakce je výhodné provádět za nízkých teplot, čímž se omezí vedlejší reakce (a zlepší selektivita) a tím i výtěžnost (protože se sníží míra vypařování plynných reaktantů z roztoku).
Výchozí látky se před reakcí někdy ochladí natolik, že teplo uvolněné reakcí je absorbováno, aniž by bylo nutné reakční směs dále chladit. U plynných nebo nízkovroucích reaktantů je potřebný přetlak.
Vzhledem k velkému počtu možných výchozích látek je popsáno i mnoho různých fotochemických reakcí.[13][14]
Příklady studií
[2+2] cykloadice
Alkeny se mohou dimerizovat působením ultrafialového záření.[15]
Přesmyk 4,4-difenylcyklohexadienonu
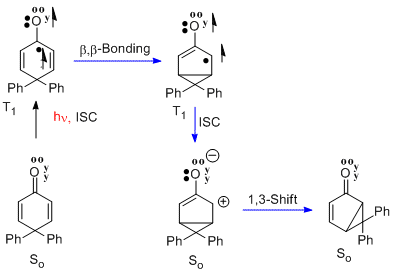
Obdobou přeměny santoninu na lumisantonin je přesmyk 4,4-difenylcyklohexadienonu.[9] V tomto případě n-π* tripletový excitovaný stav prochází stejnou beta-beta reakcí. Následně se vytvoří singletový zwitterion v základním stavu. Posledním krokem je přesmyk, kterým vzniká bicyklická sloučenina. Reakce patří mezi cyklohexadienonové přesmyky typu A.
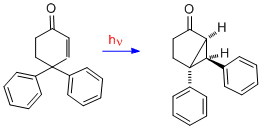
4,4-difenylcyklohexenon
Přesmyk 4,4-difenylcyklohexenonu se liší od předchozích tím, že jsou k přesmykům typu A potřeba dvě dvojné vazby. Dvojná vazba na jedné z fenylových skupin, původně na C-4, se přesouvá na C-3 (tedy beta uhlík).[16]
Pokud je na jeden z arylů navázána para-kyano nebo para-methoxyskupina, tak se tento aryl přesouvá přednostně.[17]Zkoumáním fenoniových sloučenin, u kterých se aryl začal přesouvat na beta-uhlík, bylo zjištěno, že za přítomnosti substituentu v poloze para zvyšuje míru delokalizace elektronů a tato reakční dráha je tak více stabilizovaná.

n-π* reaktivita
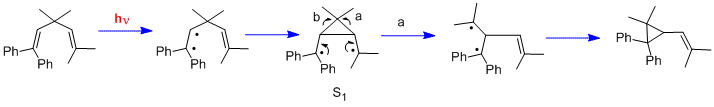
Dalším druhem fotochemické reakce je di-pí-methanový přesmyk;[18] patří sem například přesmyky 1,1,5,5-tetrafenyl-3,3-dimethyl-penta-1,4-dienu[19] a barrelenu na semibullvalen.[20]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Organic photochemistry na anglické Wikipedii.
- ↑ P. Klán, J. Wirz Photochemistry of Organic Compounds: From Concepts to Practice. Wiley, Chichester, 2009, ISBN 978-1405190886
- ↑ N. J. Turro, V. Ramamurthy, J. C. Scaiano Modern Molecular Photochemistry of Organic Molecules Archivováno 25. 7. 2019 na Wayback Machine.. University Science Books, Sausalito, 2010, ISBN 978-1891389252
- ↑ Heinz D. Roth. The Beginnings of Organic Photochemistry. Angewandte Chemie International Edition in English. 1989, s. 1193–1207. doi:10.1002/anie.198911931.
- ↑ Karl Elbs. Ueber Paranthracen. Journal für Praktische Chemie. 1891-06-30, s. 467–469. Dostupné online. ISSN 0021-8383. doi:10.1002/prac.18910440140.
- ↑ E. Havinga; R. O. De Jongh; W. Dorst. Photochemical acceleration of the hydrolysis of nitrophenyl phosphates and nitrophenyl sulphates. Recueil des Travaux Chimiques des Pays-Bas. 1956, s. 378–383. doi:10.1002/recl.19560750403.
- ↑ Robert Burns Woodward; Roald Hoffmann. The Conservation of Orbital Symmetry. Angewandte Chemie International Edition. 1969, s. 781–853. doi:10.1002/anie.196907811.
- ↑ Robert Burns Woodward; Roald Hoffmann. The Conservation of Orbital Symmetry. Weinheim: Verlag Chemie, Academic Press, 1971. Dostupné online. ISBN 978-1483256153.
- ↑ The Photochemical Rearrangement of 4,4-Diphenylcyclohexadienone. Paper I on a General Theory of Photochemical Reactions, Zimmerman, H. E.; Schuster, D. I. Journal of the American Chemical Society, 1961, 83, 4486-4487
- ↑ a b Howard E. Zimmerman; David I. Schuster. A New Approach to Mechanistic Organic Photochemistry. IV. Photochemical Rearrangements of 4,4-Diphenylcyclohexadienone. Journal of the American Chemical Society. 1962, s. 4527–4540. doi:10.1021/ja00882a032.
- ↑ Mario Schiavello: Photoelectrochemistry, Photocatalysis and Photoreactors Fundamentals and Developments. Springer Netherlands, 2009, ISBN 978-90-481-8414-9, p. 564
- ↑ Martin Fischer: Industrial Applications of Photochemical Syntheses, Angewandte Chemie International Edition in English. 17, 1978, p. 16–26, doi:10.1002/anie.197800161
- ↑ Dieter Wöhrle, Michael W. Tausch, Wolf-Dieter Stohrer: Photochemie: Konzepte, Methoden, Experimente. Wiley & Sons, 1998, ISBN 978-3-527-29545-6, p. 271–275
- ↑ DU PONT. Process of Chlorination. Původci vynálezu: F. Sparre, W. E. Masland. US. Grant 1379367. 1921-05-24. Dostupné: <online>.
- ↑ Process and Apparatus for the Chlorination of Methane. Původci vynálezu: Ziffer Fritz, Richard Leiser. US. Grant 1459777. 1920-02-14. Dostupné: <online>.
- ↑ R. L. Cargill; J. R. Dalton; G. H. Morton; W. E. Photocyclization of an Enone to an Alkene: 6-Methylbicyclo[4.2.0]Octan-2-One. Organic Syntheses. 1984, s. 118. doi:10.15227/orgsyn.062.0118.
- ↑ Mechanistic and Exploratory Organic Photochemistry, IX. Phenyl Migration in the Irradiation of 4.4-Diphenylcyclohexenone, Zimmerman, H. E.; Wilson, J. W. Journal of the American Chemical Society, 1964, 86, 4036-4042
- ↑ Photochemical Migratory Aptitudes in Cyclohexenones. Mechanistic and Exploratory Organic Photochemistry. XXIII, Zimmerman, H. E.; Rieke, R. D.; Scheffer, J. R. Journal of the American Chemical Society, 1967, 89, 2033-2047
- ↑ Unsymmetrical Substitution and the Direction of the Di-pi-Methane Rearrangement; Mechanistic and Exploratory Organic Photochemistry. LVI, Zimmerman, H. E.; Pratt, A. C. Journal of the American Chemical Society, 1970, 92, 6259-6267
- ↑ The Di-pi-Methane Rearrangement. Interaction of Electronically Excited Vinyl Chromophores. Zimmerman, H. E.; Mariano, P. S. Journal of the American Chemical Society, 1969, 91, 1718-1727
- ↑ Zimmerman, H. E.; Grunewald, G. L. (1966). The Chemistry of Barrelene. III. A Unique Photoisomerization to Semibullvalene. Journal of the American Chemical Society 88 (1): 183–184 doi:10.1021/ja009
Související články
Média použitá na této stránce
Autor: Hezimmerman, Licence: CC BY-SA 3.0
This is the rearrangement of 4,4-diphenylcyclohexenone without mechanistic detail
Autor: Hezimmerman, Licence: CC BY-SA 3.0
An improved version of the Regioselective aryl type-b enone rearrangement
Autor: Hezimmerman, Licence: CC BY-SA 3.0
This give two equations of work by Egbert Havinga illustrating the unusual Meta effect
Autor: Ivogt, Licence: CC BY-SA 3.0
Diagram showing the FMO picture of the WH rules for 4n electron electrocyclization under photo control.
Autor: Masohe, Licence: CC BY-SA 4.0
Philips HPK125 UV lamp in a photochemical immersion well reactor 50 mL
Autor: Hezimmerman, Licence: CC BY-SA 3.0
A corrected version of the image drawing DiPh Dienone.gif, now DiPh-Dienone.gif