Organické sloučeniny bismutu

Organické sloučeniny bismutu jsou organokovové sloučeniny obsahující vazby mezi atomy uhlíku a bismutu. Nemají mnoho využití.[1][2]
Obvyklými oxidačními čísly bismutu jsou III a V, stejně jako u ostatních těžších prvků 15. skupiny. Disociační entalpie vazby prvků s uhlíkem klesají v řadě P > As > Sb > Bi.[3] Prvním popsaným využitím organobismutových sloučenin byla oxidace alkoholů pomocí Ph3Bi(OH)2, popsaná roku 1934.[4]
Vlastnosti methylovaných sloučenin v životním prostředí a organizmech jsou omezené.[5]
Objev
První známou organobismutovou sloučeninou se stal triethylbismut, připravený v roce 1850 reakcí jodethanu se slitinou bismutu a draslíku. Podobně jako většina trialkylbismutů má BiEt3 silný zápach a na vzduchu se samovolně oxiduje.[6]
Vlastnosti těchto sloučenin se začaly více zkoumat po objevu Grignardových a organolithných činidel.
Organobismutité sloučeniny
Vlastnosti a struktura

Triorganobismutité sloučeniny jsou monomerní a mají pyramidální struktury, stejně jako odpovídající fosforité sloučeniny; halogenidy ovšem bývají hypervalentní. Příkladem může být listovitá struktura methylbismutdichloridu.[7]
Existují i organobismutité heterocykly. Bismol, strukturní analog pyrrolu, nebyl izolován, ale je známa řada jeho derivátů.[8]
Bismabenzen byl laboratorně detekován.[9]
Příprava
Nejobecnějším i nejčastěji používaným postupem přípravy trialkyl- a triarylbismutitých komplexů jsou reakce bismutitých halogenidů (BiX3) s organolithnými nebo Grignardovými činidly:[6]
- BiCl3 + 3RMgX → R3Bi + 3MgXCl
nebo BiCl3 + 3LiR → BiR3 + 3LiCl.
Reakce K3Bi s organohalogenidy byla použita na přípravu prvních triorganobismutitých sloučenin:[6]
- K3Bi + 3RX → BiR3 + 3KX.
Tento postup je obtížnější a vyznačuje se nižší výtěžností. V některých případech, jako je příprava (Me3Si)3Bi, jde ovšem o jedinou použitelnou metodu.
Triarylbismutité komplexy jsou obvykle krystalické pevné látky stálé na vzduchu. Substituenty na triarylbismutitých centrech mohou být měněny.[10]

Sloučenin, které mají na atom bismutu navázány organické skupiny více druhů, se nazývají asymetrické organobismutité sloučeniny. Nejsnáze se získávají z organobismutitých halogenidů, RBiX2 a R2BiX.[6]
Reakce
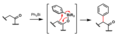
Triarylbismutité sloučeniny nemají výrazné syntetické využití.[11] Za přítomnosti Pd0 reagují s acylchloridy za vztniku fenylketonů.[12]
Tricyklopropylbismutité sloučeniny reagují podobně s arylhalogenidy a trifláty za katalýzy Pd0, přičemž se vytvářejí aryl- a heteroarylcyklopropany.[13]

Trifenylbismut reaguje s bismutitými halogenidy za vzniku smíšených derivátů, například difenylbismutchloridu (Ph2BiCl).[14]
Triarylbismutité sloučeniny lze také zapojit do vytváření vazeb C-N s vhodnými kovovými kokatalyzátory, například aminy mohou být organobismutitými reaktanty N-arylovány za přítomnosti měďnatých solí.[15]

Organobismutičné sloučeniny
Struktura
Triarylorganobismutité komplexy lze lehce oxidovat na bismutičné reakcemi s chlorem nebo bromem za vzniku Ar3BiX2 (X = Cl, Br). Reakce s jodem vedou k eliminacím a tvorbě Ar3−xBiIx, reakce s fluorem jsou příliš prudké.[6]
Vlastnosti arylových ligandů mají vliv na to, jestli bude struktura takovéhoto komplexu trigonálně bipyramidální nebo čtvercově rovinná, tyto rozdíly se projevují i na zbarvení komplexů.[6] Organobismutičné sloučeniny popsatelné obecným vzorcem Ar5Bi mají strukturu čtvercově pyramidální. Pentafenylové deriváty jsou výrazně barevné a vyznačují se termochromickými vlastnostmi, což je pravděpodobně způsobeno rovnováhou mezi čtvercově pyramidální a trigonálně bipyramidální strukturou.[16]
Příprava
Organobismutičné sloučeniny lze vytvořit přímou oxidací organobismutitých sloučenin oxidační adicí halogenů a náhradou vzniklé vazby Bi-X za vazbu Bi-C organolithným či Grignardovým činidlem, například takto:
- Me3Bi + SO2Cl2 → Me3BiCl2 + SO2
- Me3BiCl2 + 2MeLi → Me5Bi + 2LiCl
Bismutičné sloučeniny snadno tvoří protonacemi oniové ionty, například působením kyseliny p-toluensulfonové:[17]
- Ph5Bi + HO3SAr → Ph4Bi+[O3SAr−]
Pentafenylbismut vytváří átový komplex s fenyllithiem:[18]
- Ph5Bi + PhLi → Li+[Ph6Bi−]
Reakce
Bismutičné sloučeniny mají, na rozdíl od svých lehčích analogů, oxidační vlastnosti. Reakcemi Ar3BiX2 s organolithnými činidly se připravují komplexy typu Ar5Bi; prvním z nich byl fialový nestabilní Ph5Bi.[6] Organobismutičná činidla lze použít na řadu různých organických reakcí, jako jsou například oxidace primárních, sekundárních, benzylových a allylových alkoholů. Také mohou štěpit glykolys a za vhodných podmínek fungovat jako přenašeče arylových skupin.[6]
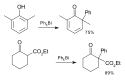
Ph3Bi(OOtBu)2, Ph3BiCO3 a (Ph3BiCl)2O byly zkoumány z hlediska využití v oxidacích oximů, thiolů, fenolů a fosfinů.[19] Ph5Bi, Ph3BiCl2 a další podobné sloučeniny mohou sloužit k arylacím arenů a 1,3-dikarbonylových sloučenin:[20]
Výše uvedená reakce probíhá asynchronním soustředěným mechanismem, kde se z O-vázané organobismutičné sloučeniny uvolňuje aryl. Jako vedlejší produkt vzniká triarylbismutitý komplex.[14]
Regioselektivitu této reakce ovlivňují vlastnosti sousedních Lewisovsky zásaditých skupin. K provedení této arylace je třeba celý ekvivalent bismutičné sloučeniny, čtyři ligandy na bismutu se dalších arylací neúčastní. Katalýza je obtížná, protože dochází k částečné zpětné oxidaci trojmocného bismutu na pětimocný.

Reference
V tomto článku byl použit překlad textu z článku Organobismuth chemistry na anglické Wikipedii.
- ↑ Thierry Ollevier. Bismuth-Mediated Organic Reactions. Topics in Current Chemistry. 2012, s. 27239. ISBN 978-3-642-27239-4. DOI 10.1007/978-3-642-.
- ↑ Axel Jacobi von Wangelin. Bismuth Reagents and Catalysts in Organic Synthesis. Transition Metals for Organic Synthesis. 2004, s. 379–394. ISBN 9783527619405. DOI 10.1002/9783527619405.ch2r.
- ↑ C. Elschenbroich, A. Salzer Organometallics : A Concise Introduction (2nd Ed) (1992) from Wiley-VCH: Weinheim. ISBN 3-527-28165-7.
- ↑ Frederick Challenger; Oswald V. Richards. 94. Organo-derivatives of bismuth and thallium. Journal of the Chemical Society. 1934, s. 405. DOI 10.1039/JR9340000405.
- ↑ Montserrat Filella. Organometallics in Environment and Toxicology. [s.l.]: [s.n.], 2010. DOI 10.1039/9781849730822-00303. Kapitola 9. Alkyl Derivatives of Bismuth in Environmental and Biological Media, s. 303–318.
- ↑ a b c d e f g h R. King. Encyclopedia of Inorganic Chemistry. [s.l.]: [s.n.], 2005. ISBN 9780470860786. S. 345–369.
- ↑ Henrik Althaus; Hans Joachim Breunig; Enno Lork. Syntheses and Chemistry of Methylantimony and Methylbismuth Dihalides: An Extended Two-Dimensional Framework in the Crystal Structure of CH3BiCl2 and Molecular Units in the Structures of [CH3ECl2(2,2'-bipyridine)] (E = Sb, Bi). Organometallics. 2001, s. 586–589. DOI 10.1021/om000749i.
- ↑ Kenneth C. Caster. Comprehensive Heterocyclic Chemistry II: Five-membered rings with one heteroatom and fused carbocyclic derivatives). [s.l.]: [s.n.], 1996. Dostupné online. ISBN 978-0-08-042725-6. Kapitola Arsoles, stiboles and bismoles, s. 857–902.
- ↑ Alexandre Gagnon; Julien Dansereau; Adrien Le Roch. Organobismuth Reagents: Synthesis, Properties and Applications in Organic Synthesis. Synthesis. 2017-03-02, s. 1707–1745. DOI 10.1055/s-0036-1589482.
- ↑ Martin Hébert, Pauline Petiot, Emeline Benoit, Julien Dansereau, Tabinda Ahmad, Adrien Le Roch, Xavier Ottenwaelder, Alexandre Gagnon. Synthesis of Highly Functionalized Triarylbismuthines by Functional Group Manipulation and Use in Palladium- and Copper-Catalyzed Arylation Reactions. The Journal of Organic Chemistry. 2016-07-01, s. 5401–5416. DOI 10.1021/acs.joc.6b00767. PMID 27231755.
- ↑ Jean Pierre Finet. Arylation reactions with organobismuth reagents. Chemical Reviews. 1989-11-01, s. 1487–1501. DOI 10.1021/cr00097a005.
- ↑ Derek H. R. Barton; Nubar Ozbalik; Manian Ramesh. The chemistry of organobismuth reagents: Part XIII ligand coupling induced by Pd(O). Tetrahedron. 1988, s. 5661–5668. DOI 10.1016/S0040-4020(01)81427-7.
- ↑ Alexandre Gagnon; Martin Duplessis; Pamela Alsabeh; Francis Barabé. Palladium-Catalyzed Cross-Coupling Reaction of Tricyclopropylbismuth with Aryl Halides and Triflates. The Journal of Organic Chemistry. 2008-05-01, s. 3604–3607. DOI 10.1021/jo702377h. PMID 18363369.
- ↑ a b Derek H. R. Barton; Neerja Yadav Bhatnagar; Jean-Pierre Finet; William B. Motherwell. Pentavalent organobismuth reagents. Part vi. Comparative migratory aptitudes of aryl groups in the arylation of phenols and enols by pentavalent bismuth reagents. Tetrahedron. 1986, s. 3111–3122. DOI 10.1016/S0040-4020(01)87378-6.
- ↑ Derek H. R. Barton; Jean-Pierre Finet; Jamal Khamsi. Copper salts catalysis of N-phenylation of amines by trivalent organobismuth compounds. Tetrahedron Letters. 1987, s. 887–890. DOI 10.1016/S0040-4039(01)81015-7.
- ↑ Arno Schmuck; Konrad Seppelt. Strukturen von Pentaarylbismut-Verbindungen. Chemische Berichte. 1989, s. 803–808. DOI 10.1002/cber.19891220502.
- ↑ H. R. Barton; Brigitte Charpiot; Elise Tran Huu Dau; William B. Motherwell; Claudine Pascard; Clotilde Pichon. Structural Studies of Crystalline Pentacalent Organobismuth Compounds. Helvetica Chimica Acta. 1984-03-14, s. 586–599. DOI 10.1002/hlca.19840670227.
- ↑ Stephan Wallenhauer; Dieter Leopold; Konrad Seppelt. Hexacoordinate organobismuth compounds. Inorganic Chemistry. 1993, s. 3948–3951. DOI 10.1021/ic00070a029.
- ↑ Organobismuth Chemistry Hitomi Suzuki, Yoshihiro Matano Elsevier, 2001
- ↑ D. H. R. Barton; J.-P. Finet. Bismuth(V) reagents in organic synthesis. Pure and Applied Chemistry. 1987, s. 937–946. DOI 10.1351/pac198759080937.
Externí odkazy
 Obrázky, zvuky či videa k tématu Organické sloučeniny bismutu na Wikimedia Commons
Obrázky, zvuky či videa k tématu Organické sloučeniny bismutu na Wikimedia Commons
Média použitá na této stránce
(c) V8rik na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Pentaphenylbismuth arylation
Autor: Mpalk95, Licence: CC BY-SA 4.0
Gagnon Synthesis of Functionalized Triaryl Bi(III) Reagents
Autor: Mpalk95, Licence: CC BY-SA 4.0
Examples of Bi(III) transferring carbon to a new metal center