Organické sloučeniny hliníku

Organické sloučeniny hliníku, též organohlinité sloučeniny, jsou chemické sloučeniny obsahující vazby mezi atomy uhlíku a hliníku. Jedná se o jednu z nejdůležitějších skupin organokovových sloučenin.[1][2] Příklady sloučenin jsou dimerní trimethylhliník, monomerní triisobutylhliník a sloučenina titanu a hliníku nazývaná Tebbeovo činidlo. Vlastnosti organohlinitých sloučenin lze vysvětlit skrz polaritu vazby C−Al a vysokou Lewisovskou kyselostí trikoordinovaných sloučenin.
V průmyslu se tyto sloučeniny nejčastěji používají na výrobu polyalkenů.
Historie
První organohlinitá sloučenina, (C2H5)3Al2I3, byla objevena v roce 1859.[3] Větší rozvoj nastal v 50. letech 20. století, kdy Karl Ziegler objevil přímou přípravu trialkylhlinitých sloučenin a zapojil je do katalytických polymerizací alkenů. Za tento objev poté získal Nobelovu cenu za chemii.
Struktura
Hlinité sloučeniny
Organohlinité sloučeniny mají obvykle tříkoordinovaná nebo čtyřkoordinovaná Al centra, u anorganických ligandů, jako například fluoridových aniontů, byla zjištěna i vyšší koordinační čísla. Jak je běžné i v jiných případech, tak čtyřkoordinované atomy nejčastěji vytváří tetraedrické struktury. Oproti boru má hliník větší atom a snadněji na sebe naváže čtyři uhlíkové ligandy. Triorganohlinité sloučeniny jsou tak často dimerní s dvojicí můstkových alkylových ligandů, příkladem může být sloučenina Al2(C2H5)4(μ-C2H5)2;i když bývá obvykle nazývána triethylhlíník, tak obsahuje dvě Al centra a šest ethylových skupin. Pokud organohlinitá sloučenina obsahuje hydridovou nebo halogenidovou skupinu, tak obvykle můstky vytváří tyto menší ligandy. Koordinační číslo 3 se objevuje, když jsou na hliník navázány rozměrné skupiny, například mesityl u trimesitylhliníku, Al(Mes)3, či isobutyl.[4]

Výměna ligandů v trialkylahlinitých sloučeninách
Trialkylhlinité sloučeniny často vytvářejí dynamické rovnováhy, vedoucí k výměnám můstkových a koncových ligandů i ligandů mezi dimery. I nekoordinujících rozpouštědlech probíhá výměna Al-Me velmi rychle, to bylo potvrzeno spektroskopií protonové nukleární magnetické rezonance; při −25 °C obsahovalo 1H NMR spektrum Me6Al2 dva signály v poměru 1:2, jak bylo očekáváno na základě struktury pevné formy. Při 20 °C byl pozorován pouze jeden signál, protože byla výměna koncových a můstkových methylových skupin příliš rychlá, než aby mohla být rozlišena pomocí NMR.[5] Vysoká Lewisovská kyselost monomerních částic je dána velikostí hlinitého centra a jeho snahou o dosažení elektronového oktetu.
Organické sloučeniny hliníku v nízkých oxidačních číslech
První organohlinitá sloučenina s vazbami Al-Al byla popsána roku 1988, šlo o (((Me3Si)2CH)2Al)2. Takovéto molekuly se obvykle získávají redukcemi dialkylhlinitých chloridů draslíkem:[6]
- (R2AlCl)2 + 2 K → R2Al-AlR2 + 2 KCl
Další významnou skupinou jsou tetraalany obsahující čtyři Al+ centra. Mají tetraedranová jádra, jak lze vidět na následujícím znázornění (Cp*Al)4 a ((Me3Si3C)Al)4. Shluk [Al12(i-Bu)12]2− byl vytvořen při výzkumu redukce organohlinitých sloučenin. Tento dianion má strukturu dvacetistěnu odpovídající dodekaboritanovému aniontu ([B12H12]2−). Formální oxidační číslo hliníku je zde menší než 1..
Příprava a výroba
Z alkylhalogenidů a hliníku
Průmyslově se jednoduché alkylované sloučeniny hliníku typu Al2R6 (R = Me, Et) vyrábějí v dvoufázovém procesu, který začíná alkylací práškového hliníku:
- 2 Al + 3 CH3CH2Cl → (CH3CH2)3Al2Cl3
Reakce je podobná výrobě Grignardových činidel. Produkt se vzorcem (CH3CH2)3Al2Cl3lze následně převést na triorganohlinité sloučeniny pomocí redukce:
- 2 (CH3CH2)3Al2Cl3 + 6 Na → (CH3CH2)6Al2 + 2 Al + 6 NaCl
Tento postup se používá na výrobu trimethylhliníku a triethylhliníku.[7]
Hydroalumince
Práškový hliník za přítomnosti vodíku přímo reaguje s některými koncovými alkeny. Proces se skládá ze dvou částí, v první se vytvoří dialkylhlinité hydridy. Reakce se obvykle provádí za vyšších teplot a vyžadují aktivaci trialkylhlinitými sloučeninami:
- 6 Al + 3 H2 + 12 CH2=CHR → 2 [HAl(CH2CHR)2]3
Pokud R skupina není příliš objemná, tak bývá produkt většinou trimerní. V následujícím kroku reaguje hydrid s dalším přídavkem alkenu a vznikne konečný produkt:
- 2 [HAl(CH2CHR)2]3 + 3 CH2=CHR → 3 [Al2(CH2CHR)3
Diisobutylhliník, jenž vytváří dimer, se získává hydridovou eliminací z triisobutylhliníku:
- 2 i-Bu3Al → (i-Bu2AlH)2 + 2 (CH3)2C=CH2
Karboaluminace
Organohlinité sloučeniny mohou reagovat s alkeny a alkyny za adice jedné organylové skupiny a kovu na násobnou vazbu; tato reakce se nazývá karboaluminace; může probíhat čistě tepelně za katalýzy přechodným kovem. Při nekatalyzované reakci je u substituovaných alkenů možná pouze monoadice. Při použití ethenu mají vzniklé produkty Poissonovo rozdělení vyšších alkylaluminovaných sloučenin. Reakce je u 1-alkenů regioselektivní.[8] ZACA reakce, kterou objevil Eiči Negiši, je asymetrická karboaluminace alkenů katalyzovaná derivátem zirkonocenu.[9]
Methylaluminace alkynů za přítomnosti Cp2ZrCl2[10][11] se používá na stereospecifickou přípravu trisubstituovaných alkenů, které jsou často obsaženy v terpenech a polyketidech. Syntézu (E)-4-jodo-3-methylbut-3-en-1-olu[12], znázorněnou níže, je jednou z těchto reakcí:
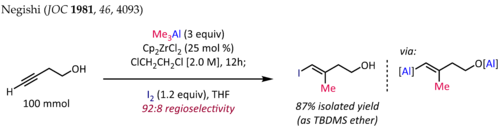
U koncových alkynů mívá reakce dobrou regioselektivitu (>90:10) a je výhradně syn-selektivní, a to i tehdy, když se v reakční směsi nachází propargylové či homopropargylové substituenty na heteroatomu. Při rozšiřování toho postupu na alkylaluminace vyššími alkyly byly ovšem dosaženy nižší výtěžnosti a špatné regioselektivity.
Příprava v laboratoři
I když jsou nižší alkylhlinité sloučeniny komerčně dostupné a nepříliš drahé, tak byla vyvinuta řada způsobů jejich laboratorní přípravy, například pomocí podvojných záměn nebo transmetalace. Reakcemi chloridu hlinitého s RLi nebo RMgX vznikají trialkylované sloučeniny:
- AlCl3 + 3 BuLi → Bu3Al + 3 LiCl
Transmetalace:
- 2 Al + 3 HgPh2 → 2 AlPh3 + 3 Hg
Reakce
V důsledku rozdělení nábojů mezi atomy hliníku a uhlíku organohlinité sloučeniny snadno reagují s elektrofily.
Lewisovská kyselost
Organohlinité sloučeniny patří podle teorie HSAB mezi tvrdé kyseliny a tvoří adukty se zásadami, například pyridinem, tetrahydrofuranem a terciárními aminy. Tyto adukty mají tetraedrické Al centra.
Reakce s elektrofily
Vazba Al–C je polarizovaná a atom uhlíku navázaný na hliník je tak silně zásaditý. Reakcemi organohlinitých sloučenin s kyselinami vznikají alkany, s alkoholy se vytváří alkoxidy:
- AlR'3 + ROH → 1/n (R'2Al−OR)n + R'H
Lze použít mnoho různých kyselin, i jednoduché minerální kyseliny.
Reakcemi s aminy vznikají amidové deriváty. Reakcemi oxidu uhličitého s trialkylhlinitými sloučeninami se vytváří dialkylhlinité karboxyláty a následně alkylhlinité dikarboxyláty:
- AlR3 + CO2 → R2AlO2CR
- R2AlO2CR + CO2 → RAl(O2CR)2
Přeměna se podobá karbonaci Grignardových činidel.[13][14][15]
Podobně se reakcemi trialkylhlinitých sloučenin s oxidem uhličitým dají připravit alkoholy, alkeny[13] nebo ketony.[16]
Působením kyslíku lze získat příslušné alkoxidy, jež mohou být hydrolyzovány na alkoholy:
- AlR3 + 3/2 O2 → Al(OR)3
Je znám také organohlinitý organický peroxid [{HC[C(Me)N-C6H5]2}Al(R)-O-O-CMe3] [R=CH(SiMe3)2].[17]
Reakce čistých trialkylhlinitých sloučenin s vodou, alkoholy, fenoly, aminy, oxidem uhličitým, oxidy síry, oxidy dusíku, halogeny a halogenovanými uhlovodíky mohou být nebezpečné.[18][19]
Polymerizace alkenů
V průmyslu se organohlinité sloučeniny, jako je methylaluminoxan, používají jako katalyzátory polymerizace alkenů.
Reference
V tomto článku byl použit překlad textu z článku Organoaluminium chemistry na anglické Wikipedii.
- ↑ D. F. Shriver; P. W. ATKINS. Inorganic Chemistry. [s.l.]: Oxford University Press, 2006. ISBN 978-0199264636. (anglicky)
- ↑ M. Witt; H. W. ROESKY. Organoaluminum chemistry at the forefront of research and development. Current Science. 2000, s. 410. Dostupné v archivu pořízeném dne 2014-10-06. (anglicky)
- ↑ Hallwachs, W.; SCHAFARIK, A. Ueber die Verbindungen der Erdmetalle mit organischen Radicalen. Liebigs Annalen. 1859, s. 206–209. Dostupné online. DOI 10.1002/jlac.18591090214. (anglicky)
- ↑ C. Elschenbroich. Organometallics. 3rd. vyd. Weinheim: Wiley-VCH, 2006. ISBN 978-3-527-29390-2. (anglicky)
- ↑ COTTON, Frank Albert; WILKINSON, GEOFFREY. Advanced Inorganic Chemistry. [s.l.]: [s.n.], 1980. ISBN 978-0-471-02775-1. S. 343. (anglicky)
- ↑ Uhl, W. Organoelement Compounds Possessing Al-Al, Ga-Ga, In-In, and Tl-Tl Single Bonds. [s.l.]: [s.n.], 2004. ISBN 9780120311514. DOI 10.1016/S0065-3055(03)51002-4. S. 53–108. (anglicky)
- ↑ Michael J. Krause, Frank Orlandi, Alfred T. Saurage and Joseph R. Zietz "Aluminum Compounds, Organic" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim DOI:10.1002/14356007.a01_543
- ↑ Barry M. Trost; MARTIN F. SEMMELHACK; IAN FLEMING. Comprehensive Organic Synthesis: Additions to and substitutions at C-C[pi]-Bonds. [s.l.]: Pergamon, 1992. ISBN 9780080405957. (anglicky)
- ↑ NEGISHI, Ei-ichi. Discovery of ZACA reaction : Zr-catalyzed asymmetric carboalumination of alkenes. Arkivoc. 2011, s. 34–53. Dostupné online. DOI 10.3998/ark.5550190.0012.803. (anglicky)
- ↑ NEGISHI, Ei-ichi; WANG, Guangwei; RAO, Honghua; XU, Zhaoqing. Alkyne Elementometalation−Pd-Catalyzed Cross-Coupling. Toward Synthesis of All Conceivable Types of Acyclic Alkenes in High Yields, Efficiently, Selectively, Economically, and Safely: "Green" Way. The Journal of Organic Chemistry. 2010-05-14, s. 3151–3182. DOI 10.1021/jo1003218. PMID 20465291. (anglicky)
- ↑ NEGISHI, Ei-ichi. Organometallics In Synthesis: A Manual (Ed. M. Schlosser). Chichester, West Sussex, UK: Wiley, 2002. ISBN 978-0471984160. S. 963–975. (anglicky)
- ↑ RAND, Cynthia L.; HORN, David E. Van; MOORE, Mark W.; NEGISHI, Eiichi. A versatile and selective route to difunctional trisubstituted (E)-alkene synthons via zirconium-catalyzed carboalumination of alkynes. The Journal of Organic Chemistry. 2002-05-01, s. 4093–4096. DOI 10.1021/jo00333a041. (anglicky)
- ↑ a b YUR'EV, V. P.; KUCHIN, A. V.; TOLSTIKOV, G. A. Reaction of aluminum trialkyls with carbon dioxide. Organic and Biological Chemistry. 1974, s. 817–819. DOI 10.1007/BF00923507. (anglicky)
- ↑ ZIEGLER, K. Neue Entwicklungen der metallorganischen Synthese. Angew. Chem.. 1956, s. 721–729. DOI 10.1002/ange.19560682302. (anglicky)
- ↑ ZAKHARKIN, L. I.; GAVRILENKO, V. V.; IVANOV, L. L. Zh. Obshch. Khim.. 1967, s. 992. (anglicky)
- ↑ David W. Marshall, US patent US3168570, assigned to Continental Oil
- ↑ W. Uhl; B. JANA. A persistent alkylaluminum peroxide: Surprising stability of a molecule with strong reducing and oxidizing functions in close proximity. Chemistry—A European Journal. 2008, s. 3067–3071. DOI 10.1002/chem.200701916. PMID 18283706. (anglicky)
- ↑ Cameo Chemicals SDS
- ↑ Handling Chemicals Safely 1980. p. 929
Externí odkazy
 Obrázky, zvuky či videa k tématu Organické sloučeniny hliníku na Wikimedia Commons
Obrázky, zvuky či videa k tématu Organické sloučeniny hliníku na Wikimedia Commons
Média použitá na této stránce
Autor: Ymwang42, Licence: CC BY-SA 4.0
synthesis of iodo-olefin fragment, commonly employed in natural product synthesis
The ball-and-stick model of diisobutylaluminium hydride, also known as DIBALH, DIBAL, DIBAL-H or DIBAH, showing aluminium as pink, carbon as black, and hydrogen as white.
Ball-and-stick model of trimethylaluminum, AlMe3 (i.e. Al(CH3)3. The compound forms a dimer in the crystal structure. The structure wass determined by neutron powder diffraction, reported in Organometallics (2000) 19, 4398-4401 (CSD Entry: TRMEAL03).
Colour code:
- Aluminium, Al: pink-brown
- Carbon, C: grey
- Hydrogen, H: white