Organické sloučeniny kobaltu
Organické sloučeniny kobaltu jsou organokovové sloučeniny obsahující vazby mezi atomy uhlíku a kobaltu. Využívají se v několika organických reakcích a patří mezi ně i vitamin B12. Řada těchto sloučenin, jako například oktakarbonyl dikobaltu, má katalytické vlastnosti.[1]
Alkylové komplexy

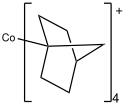
Většina komplexů kobaltu obsahuje jenom alkylové ligandy; příkladem může být Co(4-norbornyl)4 a jeho kation.[3]
Do alkylkobaltů lze zařadit například vitamin B12. U methylkobalaminu je ligandem methylová skupina, která je elektrofilní, v případě vitaminu B12 jde o adenosylovou skupinu. Podobné vitaminu B12 jsou porfyriny, dimethylglyoximáty a podobné komplex ligandů obsahujících Schiffovy zásady. Tyto sloučeniny také vytváří alkylové deriváty, které mohou vstupovat do řady reakcí a biochemických dějů. Malou sílu vazby kobaltitého iontu v analozích vitaminu B12 lze vysvětlit radikálovou polymerizací akrylových a vinylsloučenin (jako jsou vinylacetát, kyselina akrylová a akrylonitril.[4]
Karbonylové komplexy
Oktakarbonyl dikobaltu reaguje s vodíkem a alkeny za vzniku aldehydů; tato reakce tvoří základ hydroformylace, přípravy aldehydů z alkenů, CO a vodíku. Významným meziproduktem je hydrid tetrakarbonylkobaltu (HCo(CO)4). Při původním procesu byl vyráběn propanal z ethenu a syntézního plynu za katalýzy oktakarbonylem dikobaltu; tento postup byl nahrazen používáním katalyzátorů založených na rhodiu. Procesy využívající kobalt se většinou používají na výrobu 7-14uhlíkatých alkoholů, dále přeměňovaných na tenzidy.[5]

Při hydrokarboxylacích se místo vodíku vyskytuje voda nebo alkohol a produktem je karboxylová kyselina nebo ester, jako příklad může sloužit přeměna buta-1,3-dienu na kyselinu adipovou. Katalyzátory tvořené kobaltem (společně se železem) se také používají při Fischerových–Tropschových syntézách, kdy se tvoří oganokobaltové meziprodukty.
Alkynové deriváty Co2(CO)8
Oktarbonyl dikobaltu také může reagovat s tetraedrany typu Co2(CO)6(C2R2). Vzhledem k tomu, že kobaltová centra je poté možné oddělit, tak pro alkyn představují chránicí skupiny. V Nicholasově reakci je také alkyn chráněn, současně se alfa uhlík aktivuje pro nukleofilní substituci.
Cyklizace
Sloučeniny kobaltu reagují s dieny a diyny v cyklometalacích za tvorby cyklických produktů. Na vazbu Co-C se poté mohou navázat alkyny, alkeny, nitrily nebo oxid uhelnatý. Reakcemi založenými na tomto principu jsou Pausonova–Khandova reakce (navázání CO) a trimerizace alkynů (například pomocí dikarbonylu cyklopentadienylkobaltu).
Cp, allylové a alkenové sloučeniny
Sendvičové sloučeniny
Organokobaltové sloučeniny mohou obsahovat alkenové, allylové, dienové a Cp ligandy. Takovou sendvičovou sloučeninou je například kobaltocen, 19elektronový metalocen používaný jako redukční činidlo a zdroj CpCo. Dále lze uvést CoCp(C6Me6) s 20 a Co(C6Me6)2, s 21 elektrony. Redukcí bezvodého chloridu kobaltnatého sodíkem za přítomnosti cyklooktadienu vzniká Co(cyklooktadiene)(cyklooktenyl), který lze synteticky využít.[8]
CpCo(CO)2 a deriáty
Polosendvičové sloučeniny, jako dikarbonyl cyklopentadienylkobaltu (CpCo(CO)2) a alkenové komplexy CpCo(C2H4)2 a CpCo(cod), jsou užitečnými katalyzátory trimerizací alkynů,[9] kde mohou být použity k vytváření řady komplexních struktur.[10]
Další příklad
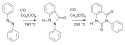
Jedním z prvních využití organokobaltových sloučenin se stala karbonylace azobenzenu oktakarbonylem dikobaltu:[11]
Reference
V tomto článku byl použit překlad textu z článku Organocobalt chemistry na anglické Wikipedii.
- ↑ Iwao Omae. Three characteristic reactions of organocobalt compounds in organic synthesis. Applied Organometallic Chemistry. 2007, s. 318–344. DOI 10.1002/aoc.1213.
- ↑ B. K. Bower; H. G. Tennent. Transition metal bicyclo[2.2.1]hept-1-yls. Journal of the American Chemical Society. 1972, s. 2512–2514. DOI 10.1021/ja00762a056.
- ↑ Chybí název periodika! DOI 10.1021/ja00238a066. (anglicky)
- ↑ Antoine Debuigne; Rinaldo Poli; Christine Jérôme; Robert Jérôme; Christophe Detrembleur. Overview of cobalt-mediated radical polymerization: Roots, state of the art and future prospects. Progress in Polymer Science. 2009, s. 211–239. DOI 10.1016/j.progpolymsci.2008.11.003.
- ↑ Boy Cornils, Wolfgang A. Herrmann, Chi-Huey Wong, Horst Werner Zanthoff: Catalysis from A to Z: A Concise Encyclopedia, 2408 Seiten, Verlag Wiley-VCH Verlag GmbH & Co. KGaA, (2012), ISBN 3-527-33307-X.
- ↑ Richard F. Heck; David S. Breslow. The Reaction of Cobalt Hydrotetracarbonyl with Olefins. Journal of the American Chemical Society. 1961, s. 4023–4027. DOI 10.1021/ja01480a017.
- ↑ Jack Halpern. Organometallic chemistry at the threshold of a new millennium. Retrospect and prospect. Pure and Applied Chemistry. 2001, s. 209–220. DOI 10.1351/pac200173020209.
- ↑ L. W. Gosser; M. A. Cushing. π-Cyclooctenyl-π-1,5-cyclooctadienecobalt. [s.l.]: [s.n.], 1977. ISBN 9780470132487. DOI 10.1002/9780470132487.ch32. Kapitola Π-Cyclooctenyl-π-L,5-Cycloocta-Dienecobalt, s. 112–115.
- ↑ Cobalt-Catalyzed Cyclotrimerization of Alkynes: The Answer to the Puzzle of Parallel Reaction Pathways Nicolas Agenet, Vincent Gandon, K. Peter C. Vollhardt, Max Malacria, Corinne Aubert Journal of the American Chemical Society; 2007; 129(28) pp 8860 - 8871; (Article) DOI:10.1021/ja072208r
- ↑ V. J. Chebny; D. Dhar; S. V. Lindeman; R. Rathore. Simultaneous Ejection of Six Electrons at a Constant Potential by Hexakis(4-ferrocenylphenyl)benzene. Organic Letters. 2006, s. 5041–5044. Dostupné online. DOI 10.1021/ol061904d. PMID 17048838.
- ↑ Shunsuke Murahashi; Shigeki Horiie. The reaction of azobenzene and carbon monoxide. Journal of the American Chemical Society. 1956, s. 4816. DOI 10.1021/ja01599a079.
Externí odkazy
 Obrázky, zvuky či videa k tématu Organické sloučeniny kobaltu na Wikimedia Commons
Obrázky, zvuky či videa k tématu Organické sloučeniny kobaltu na Wikimedia Commons
Média použitá na této stránce
(c) V8rik na projektu Wikipedie v jazyce angličtina, CC-BY-SA-3.0
Alkyne trimerization Mechanism
chemical structure of Co(4-norbornyl)4+
(c) V8rik na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Cobalt Catalyzed reaction Azobenzene Carbon monoxide Murahashi 1956
Autor: Smokefoot, Licence: CC BY-SA 3.0
structure of cyclooctadiene-cyclooctenyl cobalt(I)
Chemical structure of cobalamin.