Organické sloučeniny niklu
Organické sloučeniny niklu jsou organokovové sloučeniny obsahující vazby mezi atomy uhlíku a niklu.[1][2] Mohou být použity jako katalyzátory, jako stavební prvky v organické chemii a při chemické depozici z plynné fáze. Také se vyskytují jako krátkodobé meziprodukty organických reakcí.
První připravenou organoniklovou sloučeninou byl roku 1890 tetrakarbonyl niklu (Ni(CO)4), jenž byl záhy využit při Mondově procesu přečišťování niklu. Organické komplexy niklu se zapojují do mnoha průmyslových procesů, jako například karbonylací a hydrokyanací.[3]
Rozdělení

Alkylové a arylové komplexy
Často používaným reaktantem je Ni(CH3)2(tetramethylethylendiamin).[4]
Je znám velký počet alkylových a arylových komplexů s obecným vzorcem NiR(X)L2, jako například [(dppf)Ni(cinnamyl)Cl)], trans-(PCy2Ph)2Ni(o-tolyl)Cl, (dppf)Ni(o-tolyl)Cl, (TMEDA)Ni(o-tolyl)Cl a (TMEDA)NiMe2.

Sloučeniny typu NiR2 mohou mít i 12 valenčních elektronů. V roztocích ovšem rozpouštědlo interaguje s atomem kovu a zvyšuje tak počet elektronů. Sloučeninou s 12 valenčními elektrony je například di(mesityl)nikl, připravovaný z (allyl)2Ni2Br2 a odpovídajícího Grignardova činidla.
- (allyl)2Ni2Br2 + 4 C6H2Me3MgBr → 2 (allyl)MgBr + 2 MgBr2 + 2 (C6H2Me3)2Ni
Alkenové komplexy
Je také popsána řada sloučenin, kde je nikl koordinován na alken. Tyto komplexy se využívají například při polymerizacích a oligomerizacích alkenů.[6]
V těchto sloučeninách má nikl oxidační číslo 0 a vazba se popisuje Dewarovým–Chattovým–Duncansonovým modelem; jako příklad lze uvést bis(cyklooktadien)nikl (Ni(COD)2), obsahující dva cyklooktadienové ligandy. Má 18 valenčních elektronů, z nichž 10 dodává samotný nikl a po čtyřech každá ze dvou dvojných vazeb. Tato pevná látka, tající při 60 °C, se používá jako katalyzátor a jako prekurzor dalších sloučenin niklu.
Allylové komplexy

Allylhalogenidy reagují s Ni(CO)4 za vzniku pí-allylových komplexů, (allyl)2Ni2Cl2.[7] Tyto komplexy slouží jako zdroje allylových nukleofilů. U (allyl)2Ni2Br2 a (allyl)Ni(C5H5) má nikl oxidační číslo +2 a 16 a 18 elektronů.
Komplexy s cyklopentadienylem
Niklocen
Niklocen, NiCp2, obsahujeícíNi2+ a 20 valenčních elektronů, je nejvýznamnějším metalocenem niklu. Může být oxidován jedním elektronem. Odpovídající sloučeniny palladia (palladocen) a platiny (platinocen) nejsou známy. Od niklocenu je odvozena řada derivátů, jako CpNiLCl, CpNiNO a Cp2Ni2(CO)3.
Komplexy s karbeny
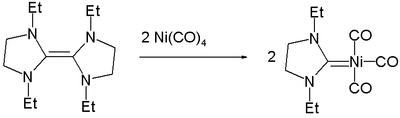
Nikl vytváří komplexy i s karbeny, v nich se nachází dvojné vazby C=Ni.[8]
Reakce
Oligomerizace alkenů a alkynů
Sloučeniny niklu katalyzují oligomerizace alkenů a alkynů; tato vlastnost byla využita při vývoji Zieglerových–Nattových katalyzátorů. Tento objev ukázal, že nečistoty v niklu, pocházející z autoklávu, způsobuj převahu terminace reakce koncového alkenu nad propagací a zastavení polymerizace ethenu u but-1-enu. Tento jev, nazvaný niklový efekt vedl k hledání a nalezení dalších katalyzátorů těchto reakcí, které umožní tvorbu polymerů s vysokými molekulovými hmotnostmi, podobně jako moderní Zieglerovy–Nattovy katalyzátory.
Oligomerizace alkynů se využívá například v Reppeově syntéze, jež může sloužit například na přípravu cyklooktatetraenu:
Tato reakce je [2+2+2+2]-cykloadicí. Oligomerizací buta-1,3-dienu s ethenem na trans-hexa-1,4-dien se využívala v průmyslu.
[2+2+2]-cykloadice se také objevují v trimerizacích alkynů, kde se obvykle vytváří benzyn[9] z derivátu benzenu navázaného na triflát a s trimethylsilylovým substituentem v poloze ortho; následně reaguje s diynem, například okta-1,7-diynem, za přítomnosti komplexu bromidu nikelnatého a zinku (NiBr21,2-bis(difenylfosfino)ethan / Zn) za vzniku derivátu naftalenu.
V katalytickém cyklu zinek slouží k redukci Ni2+ na Ni0, který se poté koordinuje na dvě vazby alkynu. Poté následuje cyklometalace za tvorby niklcyklopentadienového meziproduktu a koordinace benzynu za C-H inserce a vytvoří se niklcykloheptatrien. Nakonec se redukční eliminací uvolní tetrahydroantracen.
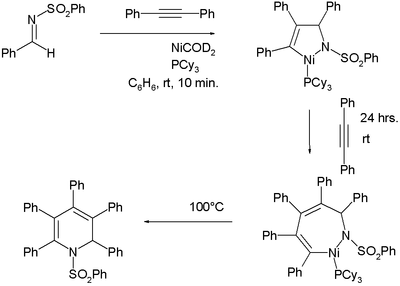
Tvorba organoniklových sloučenin takovými reakcemi nemusí být zřejmá, ale vhodně navrženým experimentem lze kvantitativně potvrdit tvorbu dvou meziproduktů:[10]
Bylo zjištěno,[11] že tato reakce je použitelná pouze u samotného acetylenu či jednoduchých alkynů, protože má špatnou regioselektivitu. Z jednoho koncového alkynu může vzniknout 7 různých izomerů lišících se polohou substituentů nebo dvojné vazby. Tuto nevýhodu lze překonat pomocí některých diynů:
Volbou vhodných reakčních podmínek lze také omezit vedlejší reakci v podobě [2+2+2] cykloadice vedoucí k substituovanému arenu.
Párovací reakce
Sloučeniny niklu mohou katalyzovat párování allyl- a arylhalogenidů. Katalyzátory obsahující nikl se používají i v Kumadových a Negišiových párováních.
Ni karbonylace
Ni katalyzuje adice oxidu uhelnatého na alkeny a alkyny. Při průmyslové výrobě kyseliny akrylové se používala reakce acetylenu, oxidu uhelnatého a vody při 4-5,5 MPa a 160-200 °C, katalyzovaná bromidem nikelnatým a halogenidem mědi.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Organonickel na anglické Wikipedii.
- ↑ F.A. Carey R.J. Sundberg Advanced Organic Chemistry 2nd Ed. ISBN 0-306-41199-7
- ↑ Comprehensive organometallic chemistry III Robert Crabtree, Mike Mingos 2006 ISBN 0-08-044590-X
- ↑ Valentine P. Ananikov. Nickel: The "Spirited Horse" of Transition Metal Catalysis. ACS Catalysis. 2015, s. 1964–1971. DOI 10.1021/acscatal.5b00072.
- ↑ Inigo Göttker-Schnetmann; Stefan Mecking. A Practical Synthesis of [(tmeda)Ni(CH3)2], Isotopically Labeled [(tmeda)Ni(13CH3)2], and Neutral Chelated-Nickel Methyl Complexes. Organometallics. 2020, s. 3433–3440. DOI 10.1021/acs.organomet.0c00500.
- ↑ Jason D. Shields; Erin E. Gray; Abigail G. Doyle. A Modular, Air-Stable Nickel Precatalyst. Organic Letters. 2015-05-01, s. 2166–2169. DOI 10.1021/acs.orglett.5b00766. PMID 25886092.
- ↑ H. Olivier-Bourbigou; P. A. R. Breuil; L. Magna; T. Michel; M. Fernandez Espada Pastor; D. Delcroix. Nickel Catalyzed Olefin Oligomerization and Dimerization. Chemical Reviews. 2020, s. 7919–7983. DOI 10.1021/acs.chemrev.0c00076. PMID 32786672.
- ↑ MARTIN F. SEMMELHACK AND PAUL M. HELQUIST. Reaction of Aryl Halides with π-Allylnickel Halides: Methallylbenzene. Org. Synth.. 1988, s. 115. Dostupné online. (anglicky); Coll. Vol.. S. 161. (anglicky)
- ↑ Andreas A. Danopoulos; Thomas Simler; Pierre Braunstein. N-Heterocyclic Carbene Complexes of Copper, Nickel, and Cobalt. Chemical Reviews. 2019, s. 3730–3961. DOI 10.1021/acs.chemrev.8b00505. PMID 30843688.
- ↑ Jen-Chieh Hsieh; Chien-Hong Cheng. Nickel-catalyzed cocyclotrimerization of arynes with diynes; a novel method for synthesis of naphthalene derivatives. Chemical Communications. 2005, s. 2459–2461. DOI 10.1039/b415691a. PMID 15886770.
- ↑ Formation of an Aza-nickelacycle by Reaction of an Imine and an Alkyne with Nickel(0): Oxidative Cyclization, Insertion, and Reductive Elimination Sensuke Ogoshi Haruo Ikeda, and Hideo Kurosawa Angewandte Chemie International Edition 2007, 46, 4930 –4932 DOI: 10.1002/anie.200700688
- ↑ Nickel(0)-Catalyzed [2 + 2 + 2 + 2] Cycloadditions of Terminal Diynes for the Synthesis of Substituted Cyclooctatetraenes Paul A. Wender and Justin P. Christy Journal of the American Chemical Society; 2007; 129(44) pp 13402 - 13403; DOI:10.1021/ja0763044
Literatura
- The Organic Chemistry of Nickel Volume I: Organonickel Complexes. Redakce P.W. Jolly, G. Wilke. [s.l.]: Academic Press, 1974. ISBN 9780123884015. DOI 10.1016/B978-0-12-388401-5.X5001-5. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Organické sloučeniny niklu na Wikimedia Commons
Obrázky, zvuky či videa k tématu Organické sloučeniny niklu na Wikimedia Commons
Média použitá na této stránce
(c) V8rik na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Nickeldihydroazepine intermediate
(c) V8rik na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Nickelocene
(c) V8rik at the English Wikipedia, CC BY-SA 3.0
Alkyne Trimerization Involving An Aryne
(c) V8rik at the English Wikipedia, CC BY-SA 3.0
Reppe application Wnender / Christy 2007
(c) V8rik at the English Wikipedia, CC BY-SA 3.0
Nickel Catalyzed Carbonylation