Organické sloučeniny palladia
Organické sloučeniny palladia jsou organické sloučeniny obsahující palladium. Používají se často jako katalyzátory redukcí alkenů a alkynů pomocí vodíku, přičemž se tvoří kovalentní vazby mezi atomy palladia a uhlíku. Sloučeniny palladia se také účastní párovacích reakcí vytvářejících vazby uhlík–uhlík.[1]
Historie
- 1873 – Alexandr Michajlovič Zajcev popsal redukci benzofenonu vodíkem za katalýzy palladia.
- 1894 – F. C. Phillips zjistil, že se chlorid palladnatý redukuje na palladium při styku s ethenem.[2]
- 1907 – Objev autoklávu umožnil provádět hydrogenace za vysokých tlaků.
- 1956 – Objev Wackerova procesu, ve kterém reaguje ethen s kyslíkem za vzniku acetaldehydu a katalyzátorem je směs PdCl2 a CuCl2.
- 1957 – Popsáno tetrakis(trifenylfosfin)palladium
- 1972 – Objev Heckovy reakce, spočívající v reakci halogenidu s alkenem; meziprodukty jsou sloučeniny Pd0.
- 1973 – Popsána asymetrická Trostova allylová alkylace, patřící mezi nukleofilní substituce
- 1975 – Sonogaširova reakce umožnila párování koncových alkynů s aryl- nebo vinylhalogenidy.
- 1994 – Objev Buchwaldovy–Hartwigovy aminace, vytvářející vazby C-N

Palladnaté sloučeniny
Komplexy alkenů
Na rozdíl od Ni2+, ovšem podobně jako Pt2+, vytvářejí palladnaté halogenidy řadu komplexů s alkeny. Jednou z takových sloučenin je dichlor(cyklookta-1,5-dien)palladium, u něhož lze snadno odštěpit dien, díky čemuž je vhodným prekurzorem katalyzátorů. V průmyslově využívaném Wackerův proces se přeměňuje ethen na acetaldehyd přes nukleofilní atak hydroxidy na Pd2+-ethenový meziprodukt, po němž se vytváří komplex vinylalkoholu.
Na dvojmocné palladium se také mohou navázat fullerenové ligandy.
Častými sloučeninami používanými na přípravu těchto komplexů jsou octan palladnatý a některé podobné látky, protože karboxyláty jsou dobrými odstupujícími skupinami, například trifluoroctan palladnatý může být zapojen do aromatických dekarboxylací.[3]
Allylové komplexy
Příkladem allylového komplexu palladia je dimer chloridu allylpalladnatého (APC). Allylové sloučeniny s vhodnými odstupujícími skupinami reagují s palladnatými solemi za vzniku pí-allylových komplexů s hapticitou 3. Tyto meziprodukty rovněž reagují s nukleofily, jako jsou například karboanionty odvozené od malonátových esterů[4] nebo s aminy v allylových aminacích.[5] Reaktantem je triethylfosfitový ligand DBU (který absorbuje protony z aminu, jež by mohly spustit izomerizaci) v tetrahydrofuranu (THF).
Příklady reakcí, do kterých se tyto sloučeniny zapojují, jsou allylpalladnaté Trostovy asymetrické allylové alkylace, Carrollovy přesmyky a oxo varianty Saegusových–Itoových oxidací.
Komplexy s vazbami sigma mezi palladiem a uhlíkem
Na palladium se může navázat mnoho různých organických skupin za tvorby stabilních komplexů obsahujících vazby sigma. Stabilita vazeb vyjádřená jejich disociačními energiemi klesá v této řadě: Pd-alkynyl > Pd-vinyl ≈ Pd-aryl > Pd-alkyl a délka vazeb kov-uhlík se mění v opačném směru: Pd-alkynyl < Pd-vinyl ≈ Pd-aryl < Pd-alkyl.[6]
Sloučeniny palladia0
Ke komplexním sloučeninám palladia v oxidačním čísle 0 patří tris(dibenzylidenaceton)dipalladium a tetrakis(trifenylfosfin)palladium. Tyto komplexy reagují s halogenderiváty uhlovodíků (R-X) v oxidačních adicích za tvorby R-Pd-X meziproduktů obsahujících kovalentní vazby Pd-C. Tyto reakce tvoří základy mnoha organických reakcí nazývaných párovací reakce; příkladem může být Sonogaširova reakce:
Organopalladičité sloučeniny
První organopalladičitá sloučenina byla popsána v roce 1986, jednalo se o komplex Me3Pd(IV)(I)bpy (bpy =2,2'-bipyridin),[7] připravený oxidační adicí jodmethanu na Me2Pd(II)bpy.
Reaktivitu sloučenin palladia způsobuje snadnost přeměn mezi Pd0 a Pd2+ meziprodukty. Přeměny Pd2+ na Pd4+ při organokovových reakcích řízených palladiem ovšem nebyly potvrzeny.[8]
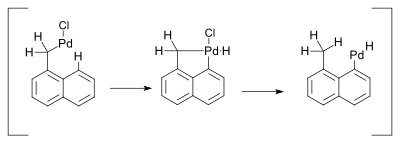
V roce 2000 byl navržen mechanismus jedné takové reakce, jednalo se o Heckovu reakci. Při ní dochází k 1,5-přesunu vodíku za přítomnosti aminů:[9]
Přesun hydridu pravděpodobně probíhal přes palladičitý metalocyklický meziprodukt:
V podobné studii obsahoval meziprodukt spojený s hydridovým přesmykem Pd2+:[10]
a v jiné práci zabývající se přípravou indolů s využitím dvou přesunů Pd) se tvořila chemická rovnováha mezi různými palladacyklickými sloučeninami:[11] Reaktanty byly tyto: difenylacetylen, octan palladnatý, bis(difenylfosfino)methan (dppm) a cesná sůl kyseliny pivalové (CsPiv).
U některých vnitromolekulárních párovacích reakcí bylo zjištěno, že jejich syntetická využitelnost nezávisí na oxidačním čísle:[12]
Reference
V tomto článku byl použit překlad textu z článku Organopalladium na anglické Wikipedii.
- ↑ Handbook of Organopalladium Chemistry for Organic Synthesis Ei-Negishi John Wiley (2002) ISBN 0-471-31506-0
- ↑ Phillips, F. C.; Am. Chem. J. 1894, 16, 255.
- ↑ Joshua S. Dickstein; Carol A. Mulrooney; Erin M. O'Brien; Barbara J. Morgan; Marisa C. Kozlowski. Development of a Catalytic Aromatic Decarboxylation Reaction. Organic Letters. 2007, s. 2441–2444. DOI 10.1021/ol070749f. PMID 17542594.
- ↑ JAN-E. BÄCKVALL AND JAN O. VÅGBERG. Stereoselective 1,4-Functionalizations of Conjugated Dienes: cis- and trans-1-Acetoxy-4-(Dicarbomethoxymethyl)-2-Cyclohexene. Org. Synth.. 1993. Dostupné online. (anglicky); Coll. Vol.. S. 5. (anglicky)
- ↑ Igor Dubovyk; Iain D. G. Watson; Andrei K. Yudin. Chasing the Proton Culprit from Palladium-Catalyzed Allylic Amination. Journal of the American Chemical Society. 2007, s. 14172–14173. DOI 10.1021/ja076659n. PMID 17960935.
- ↑ V. P. Ananikov et al., Organometallics, 2005, 24, 715. DOI:10.1021/om0490841
- ↑ Peter K. Byers; Allan J. Canty; Brian W. Skelton; Allan H. White. The oxidative addition of lodomethane to [PdMe2(bpy)] and the X-ray structure of the organopalladium(IV) product fac-[PdMe3(bpy)l](bpy = 2,2-bipyridyl). Chemical Communications. 1986, s. 1722–1724. DOI 10.1039/C39860001722.
- ↑ Antonio J. Mota; Alain Dedieu. Through-Space Intramolecular Palladium Rearrangement in Substituted Aryl Complexes: Theoretical Study of the Aryl to Alkylpalladium Migration Process. The Journal of Organic Chemistry. 2007, s. 9669–9678. DOI 10.1021/jo701701s. PMID 18001098.
- ↑ Liansheng Wang; Yi Pan; Xin Jiang; Hongwen Hu. Palladium catalyzed reaction of α-chloromethylnaphthalene with olefins. Tetrahedron Letters. 2000, s. 725–727. DOI 10.1016/S0040-4039(99)02154-1.
- ↑ C-H Activation and Palladium Migration within Biaryls under Heck Reaction Conditions Gunter Karig, Maria-Teresa Moon, Nopporn Thasana, and Timothy Gallagher Org. Lett., Vol. 4, No. 18, 2002 3116 DOI:10.1021/ol026426v
- ↑ Synthesis of Substituted Carbazoles by a Vinylic to Aryl Palladium Migration Involving Domino C-H Activation Processes Jian Zhao and Richard C. Larock Organic Letters, Vol. 7, No. 4, 701 2005 DOI:10.1021/ol0474655
- ↑ Pd-Catalyzed Alkyl to Aryl Migration and Cyclization: An Efficient Synthesis of Fused Polycycles via Multiple C-H Activation Qinhua Huang, Alessia Fazio, Guangxiu Dai, Marino A. Campo, and Richard C. Larock Journal of the American Chemical Society 2004, 126, 7460-7461 DOI:10.1021/ja047980y
Externí odkazy
 Obrázky, zvuky či videa k tématu Organické sloučeniny palladia na Wikimedia Commons
Obrázky, zvuky či videa k tématu Organické sloučeniny palladia na Wikimedia Commons
Média použitá na této stránce
(c) V8rik at the English Wikipedia, CC BY-SA 3.0
Heck Reaction Wang 2000 Mechanism
(c) V8rik at the English Wikipedia, CC BY-SA 3.0
Organopalladium Migration Huang 2004
Changed the obviously wrong "Pd" groups in the sidechain to the intended "Ph" groups. Cleaned up the scheme a little, otherwise tried to stay true to the style.
Catalytic cycle of Sonogashira reaction.
(c) V8rik at the English Wikipedia, CC BY-SA 3.0
Organopalladium Shift Karig 2002