Organické sloučeniny selenu
Organické sloučeniny selenu jsou organické sloučeniny obsahující vazby mezi atomy uhlíku a selenu.[1][2][3] Selen patří, tak jako kyslík a síra, mezi chalkogeny (prvky 16. skupiny) a měl by tak mít podobné chemické vlastnosti.
Organické sloučeniny selenu se ve stopových množstvích nacházejí ve vodě, půdě a usazeninách.[4]
Selen se může vyskytovat v oxidačních číslech −2, +2, +4 a +6, v organických sloučeninách je nejčastější Se2+. V rámci 16. skupiny směrem dolů výrazně klesají vazebné energie (234 kJ/mol u vazby C−Se a 272 kJ/mol u C−S) a rostou délky vazeb (C−Se 198 pm, C−S181 pm a C−O 141 pm). Sloučeniny selenu jsou silnějšími nukleofily než odpovídající sloučeniny síry a vykazují také vyšší kyselost. Hodnota pKa u XH2 je 16 u kyslíku, 7 u síry a 3,8 u selenu. Na rozdíl od sulfoxidů jsou odpovídající selenoxidy nestálé za přítomnosti β-protonů, což se využívá v řadě reakcí organoselenových sloučenin, jako jsou oxidace a eliminace selenoxidů.
První izolovanou organoselenovou sloučeninou byl v roce 1836 diethylselenid.[5][6]
Dělení podle struktury

- Selenoly (RSeH), selenové obdoby alkoholů a thiolů. Bývají poměrně nestálé a vyznačují se zápachem. Benzenselenol (neboli selenafenol) je kyselejší (pKa 5,9) než thiofenol (pKa 6,5) a snadněji se oxiduje za vzniku diselenidu. Selenafenol se připravuje redukcí difenyldiselenidu.[7]
- Diselenidy (R−Se−Se−R), ekvivalenty peroxidů a disulfidů. Jsou využitelné jako stabilní prekurzory reaktivnějších sloučenin, jako jsou selenoly a selanylhalogenidy. Nejvíce se v organické chemii používá difenyldiselenid, získávaný reakcí fenylmagnesiumbromidu se selenem na PhSeMgBr a oxidací tohoto produktu.[8]
- Selanylhalogenidy (R−Se−Cl, R−Se−Br) se připravují halogenacemi diselenidů, například bromací difenyldiselenidu se vytváří fenylselanylbromid (PhSeBr). Tyto sloučeniny slouží jako zdroje PhSe+.
- Selenidy (R−Se−R), také nazývané selenoethery, jsou obdobou etherů a thioetherů; příkladem může být dimethylselenid ((CH3)2Se). Jedná se o nejběžnější skupinu organických sloučenin selenu. Symetrické selenidy se obvykle vytváří alkylacemi selenidů alkalických kovů, například selenidu sodného. Nesymetrické selenidy je možné získat alkylacemi selenoátů. Tyto sloučeniny reagují jako nukleofily, například s halogenalkany (R'−X) vytvářejí selenoniové soli R'RRSe+X−. Dvojvazný selen může také interagovat s měkkými heteroatomy a vyvářet hypervalentní selenová centra.[6]
- Také mohou za určitých okolností fungovat jako elektrofily, například s organolithnými činidly (R'Li) vytváří átové komplexy R'RRSe−Li+.
- Selenoxidy (R−Se(O)−R) jsou analogy sulfoxidů. Lze je dále oxidovat na selenony R−Se(O)2R, obdoby sulfonů.
- Selenenové kyseliny, také nazývané SeO-selenoperoxoly (RSe−OH) jsou meziprodukty oxidací selenolů. Objevují se v některých selenoenzymech, jako je glutathionperoxidáza.
- Seleninové kyseliny (RSe(O)OH) jsou analogy sulfinových kyselin.
- Peroxyseleninové kyseliny (RSe(O)OOH) katalyzují epoxidační reakce a Baeyerovy–Villigerovy oxidace.
- Selenurany jsou hypervalentní organoselenové sloučeniny, formálně odvozené od seleničitých halogenidů, jako je SeCl4. Patří sem například sloučeniny typu ArSeCl3.[9] Chloridy se získávají chloracemi oxydichloridu seleničitého.
- Selenirany jsou tříčlenné cyklické sloučeniny podobné thiiranům, ovšem kineticky nestabilní, rozpadající se na selen a alkeny; tato vlastnost má využití v organické syntéze.[10]
- Selony (R2C=Se) jsou analogy ketonů a mají snahu vytvářet oligomery.[11] Diselenobenzochinon tvoří stabilní komplexy s kovy.[12]
- Selenomočovina je příkladem stabilní sloučeniny obsahující dvojnou vazbu C=Se.
- Selenothioperoxidy (R−Se−S−R), sloučeniny obsahující vazby selen–síra, obdoby disulfidů.
Výskyt
Selen v organických sloučeninách je významným mikroprvkem, jehož nedostatek způsobuje poruchy kostry a funkce srdečního svalu. Organoselenovíé sloučeniny jsou nezbytné pro obranu buněk proti oxidačnímu poškození a pro správné fungování imunitního systému. Také se podílejí na prevenci předčasného stárnutí a vzniku nádorů. Jako zdroj selenu složí v biosyntézách selenofosfát.
Glutathionoxidáza je příkladem enzymu se selenolovou skupinou v aktivním místě. Organické sloučeniny selenu byly také nalezeny v rostlinách, například při analýze česneku vysokoúčinnou kapalinovou chromatografií s hmotnostní spektrometrií indukčně vázaným plazmatem (HPLC-ICP-MS) bylo zjištěno, že nejvýznamnější sloučeninou selenu je zde γ-glutamyl-Se-methylselenocystein a že jsou také přítomna menší množství Se. Stopová množství dimethylselenidu a allylmethylselenidu lze nalézt v dechu lidí po konzumaci syrového česneku.[13]
Selenocystein a selenomethionin
Selenocystein je důležitý pro ribozomální syntézu bílkovin v některých organismech.[14]
Je popsáno více než 25 selenoproteinů (bílkovin obsahujících selen).[15]
Většina selenových enzymů obsahuje selenocystein, odvozený od cysteinu náhradou atomu síry selenem. Tato aminokyselina je kódována zvláštním způsobem.
Selenomethionin je další přírodní aminokyselinou obsahující selen, vzniká ovšem při posttranskripčních modifikacích.
Organoselenové sloučeniny v organické syntéze
Organoselenové sloučeniny jsou užitečnou skupinou reaktantů pro organickou syntézu, přestože se většinou používají pouze při výrobě léků. Jejich využitelnost souvisí s několika okolnostmi: nízké síle vazby C−Se a snadné oxidaci dvojvazných sloučenin selenu.
Vinylselenidy
Vinylselenidy mají význam v organické syntéze, obzvláště při vývoji stereoselektivních syntéz funkcionalizovaných alkenů.[16]
I když je známo několik způsobů přípravy vinylselenidů, tak se tyto přípravy nejčastěji zaměřují na nukleofilní nebo elektrofilní adice organoselenových sloučenin na koncové nebo vnitřní alkyny.[17][18][19][20]
Jako příklad lze uvést nukleofilní adice selenofenolu na alkyny, jejichž produkty jsou při delších reakčních časech za pokojové teploty převážně Z-vinylselenidy. Za vyšších teplot reakce probíhá rychleji; Z- a E-vinylselenidy se ovšem vytváří v poměru blízkém 1:1.[21] Produkty těchto reakcí ovšem závisí na substituentech na trojné vazbě.
Vinylselenidy lze také připravit hydroselenacemi alkynů katalyzovanými palladiem, kde se tvoří, a to s dobrou výtěžností, Markovnikovy aprodukty. Přípravy vinylselenidů mají několik omezení; při uvedených postupech se jako výchozí látky používají diorganoyldiselenidy nebo selenofenol, jež jsou těkavé, nestálé a obtížně se připravují.
Organické oxidace
Oxid seleničitý je možné použít na organické oxidace, například přeměny allylmethylenových skupin na allylalkoholy. Do těchto reakcí lze zapojit i mnoho jiných sloučenin.

Z hlediska mechanismu SeO2 reaguje s allylovými substráty pericyklicky, přičemž na začátku je enová reakce, která aktivuje vazbu C−H. Druhý krok probíhá jako [2,3] sigmatropní reakce. Oxidace oxidem seleničitým se často uskutečňují za přítomnosti katalytických množství organoselenové sloučeniny a katalyzátoru nebo kooxidantu, což může být například peroxid vodíku.
Oxidace pomocí SeO2 někdy vytváří karbonylové sloučeniny, jako jsou ketony,[22] například beta-pinen[23] a cyklohexanon vytvářejí cyklohexan-1,2-dion.[24] Oxidacemi ketonů s α-methylenovými skupinami vznikají diketony, tento druh oxidace oxidem seleničitým se nazývá Rileyova oxidace.[25]
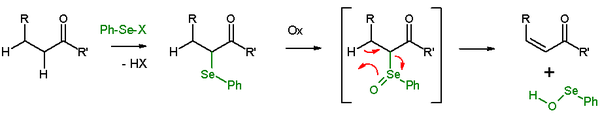
Selenoxidové eliminace
Za přítomnosti β-vodíku lze u selenidů po oxidaci provést eliminace, jejichž produkty jsou alkeny a selenenové kyseliny. Selenenové kyseliny jsou vysoce reaktivní a nelze je izolovat. Při eliminaci se všech pět zapojených reakčních center nachází ve stejné rovině a tak je stereochemie reakce typu syn. Jako oxidační činidla se zde používají peroxid vodíku, ozon nebo kyselina m-chlorperoxybenzoová. Těmito reakcemi se často přeměňují ketony na enony. Jako příklad může sloužit eliminace acetylcyklohexanonu benzenselenylchloridem a hydridem sodným.[26]
Podobnou reakcí je Griecova eliminace, obdobná selenoxidová eliminace využívající o-nitrofenylselenokyanát a tributylfosfin k odštěpování H2O.
Reference
V tomto článku byl použit překlad textu z článku Organoselenium chemistry na anglické Wikipedii.
- ↑ A. Krief, L. Hevesi, Organoselenium Chemistry I. Functional Group Transformations., Springer, Berlin, 1988 ISBN 3-540-18629-8
- ↑ S. Patai, Z. Rappoport (Eds.), The Chemistry of Organic Selenium and Tellurium Compounds, John. Wiley and Sons, Chichester, Vol. 1, 1986 ISBN 0-471-90425-2
- ↑ Paulmier, C. Selenium Reagents and Intermediates in Organic Synthesis; Baldwin, J. E., Ed.; Pergamon Books Ltd.: New York, 1986 ISBN 0-08-032484-3
- ↑ D. Wallschläger; F. Feldmann. Formation, Occurrence, Significance, and Analysis of Organoselenium and Organotellurium Compounds in the Environment. Metal Ions in Life Sciences. RSC Publishing, 2010, s. 319–364. Dostupné online. ISBN 978-1-84755-177-1.
- ↑ C. J. Löwig. Ueber schwefelwasserstoff—und selenwasserstoffäther. Annalen der Physik. 1836, s. 550–553. Dostupné online. DOI 10.1002/andp.18361130315. Bibcode 1836AnP...113..550L.
- ↑ a b Anna J. Mukherjee; Sanjio S. Zade; Harkesh Singh; Raghavan B. Sunoj. Organoselenium Chemistry: Role of Intramolecular Interactions. Chemical Reviews. 2010, s. 4357–4416. DOI 10.1021/cr900352j. PMID 20384363.
- ↑ Organic Syntheses, Coll. Vol. 3, p. 771 (1955); Vol. 24, p. 89 (1944) [1].
- ↑ Organic Syntheses, Coll. Vol. 6, p. 533 (1988); Vol. 59, p. 141 (1979) [2]
- ↑ Chemistry of hypervalent compounds (1999) Kin-ya Akiba ISBN 978-0-471-24019-8
- ↑ Link Developments in the chemistry of selenaheterocyclic compounds of practical importance in synthesis and medicinal biology Arkivoc 2006 (JE-1901MR) Jacek Młochowski, Krystian Kloc, Rafał Lisiak, Piotr Potaczek, and Halina Wójtowicz
- ↑ R. Okazaki; N. Tokitoh. Heavy ketones, the heavier element congeners of a ketone. Accounts of Chemical Research. 2000, s. 625–630. DOI 10.1021/ar980073b. PMID 10995200.
- ↑ H. Amouri; J. Moussa; A. K. Renfrew; P. J. Dyson; M. N. Rager; L.-M. Chamoreau. Discovery, Structure, and Anticancer Activity of an Iridium Complex of Diselenobenzoquinone. Angewandte Chemie International Edition. 2010, s. 7530–7533. DOI 10.1002/anie.201002532. PMID 20602399.
- ↑ E. Block. Garlic and Other Alliums: The Lore and the Science. [s.l.]: Royal Society of Chemistry, 2010. ISBN 978-0-85404-190-9.
- ↑ M. J. Axley; A. Böck; T. C. Stadtman. Catalytic properties of an Escherichia coli formate dehydrogenase mutant in which sulfur replaces selenium. Proceedings of the National Academy of Sciences of the United States of America. 1991, s. 8450–8454. DOI 10.1073/pnas.88.19.8450. PMID 1924303. Bibcode 1991PNAS...88.8450A.
- ↑ L. V. Papp; J. Lu; A. Holmgren; K. K. Khanna. From selenium to selenoproteins: synthesis, identity, and their role in human health. Antioxidants & Redox Signaling. 2007, s. 775–806. DOI 10.1089/ars.2007.1528. PMID 17508906.
- ↑ João Valdir Comasseto; Lo Wai Ling; Nicola Petragnani; Helio Alexandre Stefani. Vinylic Selenides and Tellurides - Preparation, Reactivity and Synthetic Applications. Synthesis. 1997, s. 373. DOI 10.1055/s-1997-1210.
- ↑ J. Comasseto. Vinylic selenides. Journal of Organometallic Chemistry. 1983, s. 131–181. DOI 10.1016/0022-328X(83)80118-1.
- ↑ Gilson Zeni; Marcelo P. Stracke; Cristina W. Nogueira; Antonio L. Braga; Paulo H. Menezes; Helio A. Stefani. Hydroselenation of Alkynes by Lithium Butylselenolate: an Approach in the Synthesis of Vinylic Selenides. Organic Letters. 2004, s. 1135–1138. DOI 10.1021/ol0498904. PMID 15040741.
- ↑ M. Dabdoub. Synthesis of (Z)-1-phenylseleno-1,4-diorganyl-1-buten-3-ynes: hydroselenation of symmetrical and unsymmetrical 1,4-diorganyl-1,3-butadiynes. Tetrahedron. 2001, s. 4271–4276. DOI 10.1016/S0040-4020(01)00337-4.
- ↑ O. Doregobarros; E. Lang; C. Deoliveira; C. Peppe; G. Zeni. Indium(I) iodide-mediated chemio-, regio-, and stereoselective hydroselenation of 2-alkyn-1-ol derivatives. Tetrahedron Letters. 2002, s. 7921. DOI 10.1016/S0040-4039(02)01904-4.
- ↑ J. Comasseto. Stereoselective synthesis of vinylic selenides. Journal of Organometallic Chemistry. 1981, s. 287–294. DOI 10.1016/S0022-328X(00)85812-X.
- ↑ Organic Syntheses Coll. Vol. 9, p. 396 (1998); Vol. 71, p. 181 (1993) [3] Archivováno 24. 10. 2005 na Wayback Machine.
- ↑ Organic Syntheses Coll. Vol. 6, p. 946 (1988); Vol. 56, p. 25 (1977).[4] Archivováno 1. 11. 2005 na Wayback Machine.
- ↑ Organic Syntheses, Coll. Vol. 4, p. 229 (1963); Vol. 32, p. 35 (1952). [5] Archivováno 27. 11. 2005 na Wayback Machine.
- ↑ Harry Lister Riley; John Frederick Morley; Norman Alfred Child Friend. 255. Selenium dioxide, a new oxidising agent. Part I. Its reaction with aldehydes and ketones. Journal of the Chemical Society (Resumed). 1932, s. 1875. DOI 10.1039/JR9320001875.
- ↑ Organic Syntheses Coll. Vol. 6, p. 23 (1988); Vol. 59, p. 58 (1979) [6]
Externí odkazy
 Obrázky, zvuky či videa k tématu Organické sloučeniny selenu na Wikimedia Commons
Obrázky, zvuky či videa k tématu Organické sloučeniny selenu na Wikimedia Commons
Média použitá na této stránce
Reaction scheme for the mechanism of a selenoxide oxidation.
(c) V8rik from en.wikipedia.org, CC BY-SA 3.0
Selenoxide Elimination of carbonyl compounds
Autor: MiPe, Licence: CC BY-SA 4.0
Structures of several organoselenium compounds. Drawn with ChemBioDrawUltra 12.0.2