Organické sloučeniny titanu
Organické sloučeniny titanu jsou organické sloučeniny obsahující vazby uhlík-titan. Tyto sloučeniny se používají jako reaktanty v organické chemii a zapojují se do významných průmyslových procesů.[1]
Historie
Přestože byly první pokusy o přípravu organických sloučenin titanu provedeny již v roce 1861, tak byla první popsána až v roce 1954; šlo o titanocendichlorid. Nezávisle na tomto objevu byly vytvořeny Zieglerovy–Nattovy katalyzátory založené na titanu, jež našly mnohá průmyslová využití a roku 1963 byla za jejich objev udělena Nobelova cena za chemii.
Vlastnosti
Elektronová konfigurace titanu ([Ar]3d24s2) se vzdáleně podobá té u uhlíku a podobně jako u uhlíku je převažujícím oxidačním číslem je +4. Titan má ovšem výrazně větší atomy, což se odráží na tom, že délka vazby Ti-C bývá přibližně o 30 % delší, například u tetrabenzyltitanu má 210 pm, zatímco běžná délka vazby C-C činí 155 pm. Jednoduché tetraalkyltitanové sloučeniny jsou ale většinou neizolovatelné, což je způsobeno velkými atomy titanu a nízkou elektronovou hustotou v jeho tetraedrálních komplexech. Častější a využitelnější jsou komplexy smíšených ligandů s alkoxidovými a cyklopentadienylovými koligandy. Titan může tvořit komplexy s vysokými koordinačními čísly.
Z hlediska oxidačního čísla se většina pozornosti upírá na titaničité (Ti4+) sloučeniny a titanité (Ti3+) a titanaté (Ti2+) se objevují vzácněji, i když jsou také známy; jako příklad lze uvést dikarbonyl titanocenu a Ti(CH3)2(dmpe)2. [Ti(CO)6]2− obsahuje titan s oxidačním číslem -II.[3] I když se titanité součeniny objevují při Zieglerových–Nattových katalýzách, tak jsou organotitanité sloučeniny vzácné. Příkladem takové látky je [Cp2TiIIICl]2.[4]
Vzhledem k nízké elektronegativitě titanu jsou vazby Ti-C polarizované směrem k uhlíku. Alkylové ligandy v řadě sloučenin titanu jsou tak nukleofilní. Titan je typickým oxofilem, takže se jeho sloučeniny obvykle připravují a používají za nepřístupu vzduchu. Díky vysoké oxofilitě jsou alkyly titanu účinné při odštěpování či výměnách organylových ligandů.
Sloučeniny

Alkyltitanové chloridy a alkoxidy
Jednoduché alkylové a arylové komplexy titanu, například Ti(CH2C6H5)4,[6] jsou vzácné. Bylo připraveno několik smíšených alkyltitanhalogenidových a alkyltitanalkoxidových sloučenin, i když často nejsou dobře popsané.[7] Nejpoužívanější organotitanové sloučeniny jsou ty, které se získávají reakcí chloridu titanitého a diethylaluminiumchloridu; nazývají se Zieglerovy–Nattovy katalyzátory a slouží ke katalýze polymerizace ethenu. Proces je heterogenní.
Řada dalšách sloučenin byla vytvořena z chloridu titaničitého a titaničitých alkoxidů nebo jejich směsí, podobně jako u sloučenin lithia, hořčíku a zinku. Tyto sloučeniny se občas využívají jako stechiometrické reaktanty v organické syntéze. Trichlorid methyltitanu, CH3TiCl3, lze připravit z chloridu titaničitého a dimethylzinku v dichlormethanu při -78 °C. Tato sloučenina je schopna navazovat methylové skupiny na karbonyly a halogenalkany. Podobné využití má také methyltriisopropoxytitan.[8]
Dialkyltitanové sloučeniny se účastní cyklopropanací řízených titanem, využívajících Grignardova činidla a estery. Tato reaktivita je základem Kulinkovičovy reakce:[9]
Lombardovo činidlo se používá k methylenacím;[10] strukturně se podobá „dibrommethan-Zn-Ti chloridu“.[11]
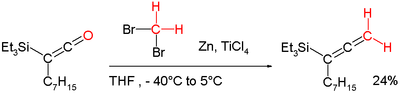
Poznatky o těchto sloučeninách byly využity při vývoji Wittigových činidel sloužících k methylenacím enolizovatelných karbonylových skupin bez ztráty stereochemické integrity. Také je lze zapojit do přeměn ketenů na alleny:[7][12]
Deriváty titanocenu
Pokusy o přípravu titanocenu, Ti(C5H5)2, vedly k tvorbě fulvalenového komplexu.[13][15]
V 70. letech 20. století byl připraven dimer titanocenu,[15][16][17] jeho struktura byla určena roku 1992[14] a následný výzkum vedl k dalším cyklopentadienylovým komplexům titanu.[13] V roce 1998 byl získán skutečný derivát titanocenu, šlo o paramagnetickou sloučeninu (C5Me4SiMe3)2Ti.[18]
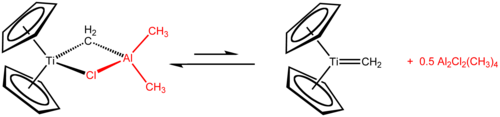
Na rozdíl od samotného titanocenu jsou jeho dichlorid a částečně i monochlorid dobře prozkoumány.[13] Tebbeovo činidlo, získávané reakcí titanocendichloridu s trimethylhliníkem, se používá jako methylenační činidlo převádějící R2C=O na R2C=CH2.
Tebbeovo činidlo reaguje s jednoduchými alkeny za tvorby titanocyklobutanů, které lze považovat za stabilní meziprodukty metateze alkenů. Tyto sloučeniny vytvářejí adukty, jako například 1,1-bis(cyklopentadienyl)-3,3-dimethyltitanocyklobutan, adukt s isobutenem, za katalýzy 4-dimethylaminopyridinem.[19]
Petasisovo činidlo, dimethyltitanocen, se připravuje z titanocendichloridu a methyllithia v diethyletheru. Oproti Tebbeovu činidlu se snadněji získává a přechovává; má rovněž využití při methylenacích.[19]
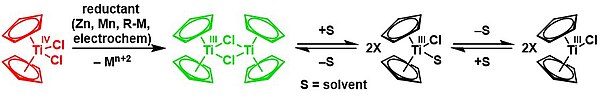
Nugentovo-RajanBabuovo činidlo, bis(cyklopentadienyl)chlorid titanitý,[20] je jednoelektronové redukční činidlo používané v organické syntéze na přípravu alkoholů protiarkovnikovovským otevíráním kruhu epoxidů; vzniká jako dimer [(η5-Cp)2Ti(μ-Cl)]2 z titanocendichloridu.[4][21][22][23]
Monocyklopentadienylové sloučeniny
LK méně využívaným, ovšem stále významným, sloučeninám patří trichlorid (cyklopentadienyl)titanu, (C5H5)TiCl3. Tennto komplex se připravuje redistriuční reakcí titanocendichloridu s chloridem titaničitým. S 12 elektrony je výrazně elektrofilnější než 16elektronový titanocendichlorid.
Komplexy arenů
Chlorid titaničitý reaguje s hexamethylbenzenem za vzniku solí kationtu [(η6-C6Me6)TiCl3]+. Redukované komplexy arenů mohou obsahovat titan v oxidačních číslech −1, 0 nebo +1.[24][25]
Karbonylové komplexy
Jsou známy i soli [Ti(CO)6]2−.[26]
Reference
V tomto článku byl použit překlad textu z článku Organotitanium compound na anglické Wikipedii.
- ↑ "Organotitanium Reagents in Organic Synthesis (Reactivity and Structure Concepts in Organic Chemistry, Vol 24)" Manfred T. Reetz 1986 ISBN 0-387-15784-0
- ↑ Michel Ephritikhine. A new look at the McMurry reaction. Chemical Communications. 1998, s. 2549–2554. DOI 10.1039/a804394i.
- ↑ Elschenbroich, C. "Organometallics" (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ↑ a b L. E. Manzer; E. A. Mintz; T. J. Marks. Cyclopentadienyl Complexes of Titanium(III) and Vanadium(III). Inorganic Syntheses. 1982, s. 84–86. ISBN 9780470132524. DOI 10.1002/9780470132524.ch18.
- ↑ Z. Dawoodi; M. L. H. Green; V. S. B. Mtetwa; K. Prout; A. J. Schultz; J. M. Williams. Evidence for Carbon–Hydrogen–Titanium Interactions: Synthesis and Crystal Structures of the Agostic alkyls [TiCl3(Me2PCH2CH2PMe2)R] (R = Et or Me). Journal of the Chemical Society, Dalton Transactions. 1986, s. 1629. Dostupné online. DOI 10.1039/dt9860001629.
- ↑ Gwyneth R. Davies; J. A. Jarvis; B. T. Kilbourn. The Crystal and Molecular Structures (At –40 °C) of the Tetrabenzyls of Titanium, Hafnium, and Tin. Journal of the Chemical Society D. 1971, s. 1511–1512. DOI 10.1039/C29710001511.
- ↑ a b Hartwig, J. F. Organotransition Metal Chemistry, from Bonding to Catalysis; University Science Books: New York, 2010. ISBN 1-891389-53-X
- ↑ René Imwinkelried; Dieter Seebach. 3'-Nitro-1-Phenylethanol by Addition of Methyltriisopropoxytitanium to m-Nitrobenzaldehyde. Organic Syntheses. 1989, s. 180. DOI 10.15227/orgsyn.067.0180.
- ↑ Jin Kun Cha; Oleg G. Kulinkovich. The Kulinkovich cyclopropanation of carboxylic acid derivatives. Organic Reactions. 2012, s. 1–159. ISBN 978-0471264187. DOI 10.1002/0471264180.or077.01.
- ↑ Luciano Lombardo. Methylenation of Carbonyl Compounds: (+)-3-Methylene-cis-p-menthane. Organic Syntheses. 1987, s. 81. DOI 10.15227/orgsyn.065.0081.
- ↑ K. Takai; Y. Hotta; K. Oshima; H. Nozaki. Tetrahedron Letters. 1978, s. 2417–2420.
- ↑ Stephen P. Marsden; Pascal C. Ducept. Synthesis of highly substituted allenylsilanes by alkylidenation of silylketenes. Beilstein Journal of Organic Chemistry. 2005, s. 5. DOI 10.15227/orgsyn.065.0081.
- ↑ a b c d R. C. Mehrotra; A. Singh. Organometallic Chemistry: A Unified Approach. [s.l.]: New Age International Publishers, 2000. ISBN 9788122412581. Kapitola 4.3.6 η5-Cyclopentadienyl d-Block Metal Complexes, s. 243–268.
- ↑ a b Sergei I. Troyanov; Helena Antropiusová; Karel Mach. Direct proof of the molecular structure of dimeric titanocene; The X-ray structure of μ(η5:η5-fulvalene)-di-(μ-hydrido)-bis(η5-cyclopentadienyltitanium)·1.5 benzene. Journal of Organometallic Chemistry. 1992, s. 49–55. DOI 10.1016/0022-328X(92)83204-U.
- ↑ a b P. C. Wailes; R. S. P. Coutts; H. Weigold. Organometallic Chemistry of Titanium, Zirconium, and Hafnium. [s.l.]: Academic Press, 1974. Dostupné online. ISBN 9780323156479. Kapitola Titanocene, s. 229–237.
- ↑ Helena Antropiusová; Alena Dosedlová; Vladimir Hanuš; Karel Mach. Preparation of μ-(η5:η5-Fulvalene)-di-μ-hydrido-bis(η5-cyclopentadienyltitanium) by the reduction of Cp2TiCl2 with LiAlH4 in aromatic solvents. Transition Metal Chemistry. 1981, s. 90–93. DOI 10.1007/BF00626113.
- ↑ Tomas Cuenca; Wolfgang A. Herrmann; Terence V. Ashworth. Chemistry of oxophilic transition metals. 2. Novel derivatives of titanocene and zirconocene. Organometallics. 1986, s. 2514–2517. DOI 10.1021/om00143a019.
- ↑ Paul J. Chirik. Group 4 Transition Metal Sandwich Complexes: Still Fresh after Almost 60 Years. Organometallics. 2010, s. 1500–1517. DOI 10.1021/om100016p.
- ↑ a b Richard C. Hartley; Jianfeng Li; Calver A. Main; Gordon J. McKiernan. Titanium carbenoid reagents for converting carbonyl groups into alkenes. Tetrahedron. 2007, s. 4825–4864. DOI 10.1016/j.tet.2007.03.015.
- ↑ Antonio Rosales, Ignacio Rodríguez-Garcia, Juan Muñoz-Bascón, Esther Roldan-Molina, Natalia M. Padial, Laura P. Morales, Marta García-Ocaña, J. Enrique Oltra. The Nugent Reagent: A Formidable Tool in Contemporary Radical and Organometallic Chemistry. European Journal of Organic Chemistry. 2015, s. 4567–4591. DOI 10.1002/ejoc.201500292.
- ↑ Yuichi Handa; Junji Inanaga. A highly stereoselective pinacolization of aromatic and α, β-unsaturated aldehydes.dta mediated by titanium(III)-magnesium(II) complex. Tetrahedron Letters. 1987, s. 5717–5718. DOI 10.1016/S0040-4039(00)96822-9.
- ↑ William A. Nugent; T. V. RajanBabu. Transition-metal-centered radicals in organic synthesis. Titanium(III)-induced cyclization of epoxy olefins. Journal of the American Chemical Society. 1988, s. 8561–8562. DOI 10.1021/ja00233a051.
- ↑ Rudolph Jungst; Dennis Sekutowski; Jimmy Davis; Matthew Luly; Galen Stucky. Structural and magnetic properties of di-μ-chloro-bis[bis(η5-cyclopentadienyl)titanium(III)] and di-μ-bromo-bis[bis(η5-methylcyclopentadienyl)titanium(III). Inorganic Chemistry. 1977, s. 1645–1655. DOI 10.1021/ic50173a015.
- ↑ David W. Blackburn; Doyle Britton; John E. Ellis. A New Approach to Bis(arene)titanium(0) and -titanium(–I) Complexes; Structure of Bis(arene)titanates(1–). Angewandte Chemie International Edition in English. 1992, s. 1495–1498. DOI 10.1002/anie.199214951.
- ↑ Fausto Calderazzo; Isabella Ferri; Guido Pampaloni; Ulli Englert; Malcolm L. H. Green. Synthesis of [Ti(η6-1,3,5-C6H3iPr3)2][BAr4] (Ar = C6H5, p-C6H4F, 3,5-C6H3(CF3)2), the First Titanium(I) Derivatives. Organometallics. 1997, s. 3100–3101. DOI 10.1021/om970155o.
- ↑ J. E. Ellis. Metal Carbonyl Anions: from [Fe(CO)4]2− to [Hf(CO)6]2− and Beyond. Organometallics. 2003, s. 3322–3338. DOI 10.1021/om030105l.
Externí odkazy
 Obrázky, zvuky či videa k tématu Organické sloučeniny titanu na Wikimedia Commons
Obrázky, zvuky či videa k tématu Organické sloučeniny titanu na Wikimedia Commons
Média použitá na této stránce
Reaktionsschema der Kulinkovich-Reaktion
Lombardo's reagent reaction
improved drawing indicating probable weakness of Ti--Ti bond
I, Smokefoot, drew and release this.
Autor: Smokefoot, Licence: CC BY-SA 4.0
Structure of (C2H5)TiCl3(dmpe), highlighting the agostic interaction.
better drawing of Cp2TiMe2