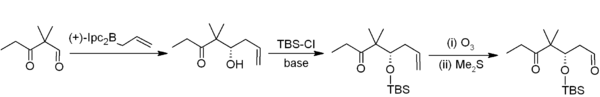Organoborany

Organoborany nebo organoborité sloučeniny jsou organické sloučeniny odvozené od boranu (BH3) náhradou jednoho nebo více vodíkových atomů organickými funkčními skupinami. Vlastnostmi těchto sloučenin se zabývá organoboranová chemie.
Organoborany jsou významnou skupinou reaktantů v organické chemii, kde umožňují mnoho různých chemických reakcí, jako jsou hydroborace. Reakce organoboranů zahrnují mezimolekulární i vnitromolekulární přenosy nukleofilních skupin navázaných na bor na elektrofilní centra. α,β-nenasycené boráty a boráty obsahující dobré odstupující skupiny v pozicích α jsou velmi náchylné k vnitromolekulárním 1,2-přesunům skupin z boru na elektrofilní pozice α. Oxidací či protonolýzou vzniklých organoboranů lze získat řadu různých organických sloučenin, například alkoholy, karbonylové sloučeniny, alkeny a alkylhalogen.[1]
Vlastnosti vazby B-C
Vazba C-B má nízkou polaritu (elektronegativita uhlíku je 2,55 a u boru 2,04), v důsledku čehož jsou alkylborany většinou stabilní, ovšem lehce oxidovatelné.
Částečně působením své nízké elektronegativity bor často vytváří sloučeniny s nedostatkem elektronů, jako jsou například triorganoborany. Vinylové a arylové skupiny dodávají elektrony a snižují elektrofilicitu a vazbám C-B dodávají částečně vlastnosti dvojných vazeb. Podobně jako boran a diboran organoborany patří mezi silné elektrofily, protože bor nemůže vytvořit úplný oktet elektronů. Na rozdíl od diboranu většina organoboranů nevytváří dimery.
Příprava
Z Grignardových činidel
Jednoduché organoborany, jako jsou triethylboran a tris(pentafluorofenyl)bor, se dají připravit reakcí trifluorboranu (v podobě etherového komplexu) a ethyl- nebo pentafluorofenylového Grignardova činidla. Boráty (R4B−) se vytváří adicí R− ekvivalentů (například RMgX a RLi) na R3B.
Z alkenů
Alkeny se mohou navázat na vazby B-H prostřednictvím hydroboračních reakcí; proces probíhá proti Markovnikovovu pravidlu. Reakce zahrnuje oxidaci nebo protonolýzu, v níž se pouze třetina výchozí látky přemění na produkt, zbývající alken/alkyn se stává součástí vedlejších produktů. Často používaným reaktantem při syntézách organoboritých sloučenin je 9-borabicyklo(3.3.1)nonan (9-BBN).[2] Hydroborace probíhá stereospecificky syn způsobem, tedy ke všem všechny dílčím reakcím dochází na stejné straně molekuly alkenu. Přechodný stav má čtvercový tvar s dvěma atomy uhlíku a jedním atomem vodíku i boru ve vrcholech, s maximálním překryvem p orbitalů alkenů a prázdným orbitalem u boru.
Borylací
C-H borylace jsou přechodnými kovy katalyzované organické reakce, při kterých vznikají organoborité sloučeniny funkcionalizacemi alifatických nebo aromatických vazeb C-H. Častým reaktantem zde bývá bis(pinakoláto)dibor.
Skupiny organoboritých sloučenin
Organoborany a hydridy
K nejvíce zkoumaným skupinám organoboranů patří sloučeniny typu BRnH3−n. Používají se jako katalyzátory, reaktanty a meziprodukty. Trialkylové a triarylové deriváty mají trojúhelníková rovinná centra tvořená atomy boru, obvykle jsou jen slabými Lewisovými kyselinami. S výjimkou derivátů s objemnými skupinami vytváří hydridy (BRnH3−n, n = 1 nebo 2) dimery, čímž připomínají strukturu diboranu. Trisubstituované organoborany, například triethylbor, jsou monomerní.[3]

Borinové a boronové kyseliny a estery (BRn(OR)3-n)
Sloučeniny typu BRn(OR)3-n se nazývají borinové estery (pokud n = 2), boronové estery (pro n = 1) a borátové estery (jestliže n = 0). Boronové kyseliny se používají v Suzukiových reakcích. Trimethylboritan, je meziproduktem při výrobě tetrahydridoboritanu sodného.
Borasubstituované aromatické sloučeniny
Borabenzen je sloučenina odvozená od benzenu náhradou jednoho CH centra atomem boru. Tyto sloučeniny mohou být izolovány jako adukty, například v podobě C5H5B-pyridinu. Cyklická sloučenina borol, strukturní analog pyrrolu, nebyla dosud izolována, podařilo se však získat její substituované deriváty. Borepin je aromatický.
Borylové sloučeniny
Borylové anionty mají obecný vzorec R2B−. Nukleofilní aniontové borylové sloučeniny se dlouho nedařilo zachytit, až v roce 2006 byla popsána boryllithná sloučenina, která reagovala jako nukleofil:[5][6] Organokovové sloučeniny obsahující vazby mezi atomy kovu a boru, například M–BR2, jsou nazývány borylovými komplexy. Obdobnými ligandy jsou boryleny (M–B(R)–M).
Neexistence lithných borylových sloučenin je zvláštní tím, že ostatní prvky 2. periody tvoří lithné soli běžně; příklady mohou být fluorid lithný, hydroxid lithný, amid lithný a organolithné sloučeniny. Tato mezera vyplývá z nízké elektronegativity boru. Reakce zásad s borohydridy (R2BH) nevedou k deprotonacím na borylové anionty typu (R2B−), místo toho se tvoří anionty typu R2B−H(zásada)+. Tento produkt má plný oktet.[7] Borylové sloučeniny se místo toho připravují redukční heterolýzou bor-bromidových vazeb kovovým lithiem. Takto utvořené boryllithné sloučeniny jsou izoelektronické s N-heteocyklickými karbeny. Byl vyvinut za účelem využití výhod aromatické stabilizace (se započtením volných elektronových párů na dusíku a prázdného p orbitalu struktura A) a kinetické stabilizace 2,6-diisopropylfenylovými skupinami. Pomocí rentgenové krystalografie byla potvrzena sp2 hybridizace atomu boru; nukleofilní adiční reakce s benzaldehydem tuto strukturu dále potvrzuje.
Alkylidenborany
Alkylidenborany typu RB=CRR s dvojnými vazbami mezi borem a uhlíkem se vyskytují vzácně; příkladem sloučeniny je borabenzen. Výchozí sloučeninou je HB=CH2, který může být detekován za nízkých teplot. Relativně stabilním derivátem je CH3B=C(SiMe3)2, který však vykazuje sklony k cyklodimerizaci.[8]
NHC adukty boru
N-heterocyklické karbeny a borany vytváří stabilní NHC boranové adukty.[9] Adukty triethylboran se dají připravit přímo z imidazoliových solí a triethylborohydridu. Tyto sloučeniny jsou předměty výzkumu díky možnému využití v podobě reaktantů nebo katalyzátorů.
Diboreny
Sloučeniny s dvojnými vazbami mezi atomy boru nejsou běžné. V roce 2007 představil Gregory Robinson z University of Georgia představil přípravu prvního neutrálního diborenu (RHB=BHR);[10][11] jako prekurzor boru byl použit bromid boritý a funkci redukčního činidla měl KC8, jenž sloužil k odštěpování potřebných protonů z diethyletheru použitého jako rozpouštědlo.
Na každý atom boru je zde navázán proton a každý takový atom je koordinován na NHC karben. Základní strukturou, na kterou jsou navázány karbenové ligandy, je diboren.[12][13]
Podobné vlastnosti mají také diboryny.
Reakce
Vazby bor-uhlík v organoboranech (R3B) a borátech (R4B−, připravované adicí R− na R3B), jsou polarizované směrem k uhlíku. Uhlíkový atom připojený k boru je tak nukleofilní[14]; u borátů lze tuto vlastnost omezit přesunem jedné R skupiny na elektrofilní centrum mezimolekulární nebo (což je častější) vnitromolekulární reakcí.[15] V druhém případě může nukleofilní skupina podstoupit 1,2-migraci k elektrofilnímu uhlíku navázanému na bor.[16] Vzniklý reorganizovaný boran je poté možné zoxidovat nebo zapojit do protonolýzy za vzniku různých organických sloučenin.

Hydroborace alkenů a alkynů je účinnou metodou přípravy boranů; použití boranu (BH3) nebo jeho ekvivalentů má jen 33% výtěžnost — zbylých 67 % alkenu nebo alkynu vytvoří vedlejší produkty obsahující bor. Tento nedostatek lze překonat použitím stechiometrického množství 9-borabicyklo[3.3.1]nonanu (9-BBN) jako hydroboračního činidla.[17]
Hydroborace-oxidace
V organické syntéze se hydroborace spojují s dalšími reakcemi za účelem vytvoření jiných funkčních skupin na místě atomu boru. Hydroboračně-oxidační reakce představují způsob přípravy alkoholů oxidací boranu peroxidem vodíku, nebo karbonylových sloučenin pomocí silnějších oxidačních činidel, jako je například oxid chromový.
Přesmyky
Trialkylborany reagují s oxidem uhelnatým. Po těchto reakcích se objevují 1,2-přesmyky, ve kterých se alkylový substituent přesouvá z boru na uhlík karbonylové skupiny. Homologované primární alkoholy lze získat reakcemi organoboranů s oxidem uhelnatým a hydridem.[18]

Allylborace
Asymetrické allylborace představují užitečné využití organoboranů při tvorbě vazeb uhlík-uhlík.[19] V následujícím příkladu, patřícím do Nicolaouovy syntézy epothilonů[20] se asymetrická allylborace (pomocí allylboranu odvozeného od chirálního alfa-pinenu) používá ve spojení s TBS jako chránicí skupinou a s ozonolýzou. Tímto způsobem dochází k dvouuhlíkové homologaci, kterou vznikají acetogeniny.
Redoxní vlastnosti
Hydridy boranů, jako jsou 9-borabicyklo(3.3.1)nonan a L-selektrid (tri-sek-butylborohydrid) se používají jako redukční činidla. Jako příklad asymetrického katalyzátoru redukcí karbonylových sloučenin lze uvést CBS katalyzátor, který je také založený na boru, čímž se dosahuje jeho koordinace na karbonylový kyslík.
Boráty
Trialkylborany, BR3, mohou být oxidovány na příslušné borátové estery, B(OR)3. Množství vazeb C-B ve sloučenině lze určit například oxidací R3B trimethylamin-N-oxidem (Me3NO) na B(OR)3. Trimethylamin (Me3N) může být následně stanoven titrací.
Boronové kyseliny (RB(OH)2) reagují s hydrogendifluoridem draselným, K[HF2], za vzniku trifluorboritanových solí, K[RBF3],[21] které jsou prekurzory nukleofilních alkyl- a arylbordifluoridů, ArBF2.[22] Soli jsou stabilnější než samotné boronové kyseliny, využití mají například při aktivaci některých aldehydů:[23]
Suzukiovy a podobné reakce
Organoborité sloučeniny lze použít k transmetalačním reakcím, jmenovitě s organickými sloučeninami palladia. Patří sem mimo jiné Suzukiova reakce, kde se aryl- nebo vinylboronové kyseliny párují s aryl- nebo vinylhalohenidy za katalýzy komplexy Pd0,[24]
: |
| () |
Tyto reakce jsou významnými způsoby vytváření vazeb uhlík-uhlík.
Mechanismus a stereochemie
Samotné borany obvykle nejsou dostatečně nukleofilní, aby způsobovaly přesuny alkylových skupin na elektrofilní centra. Po nukleofilním ataku je ovšem vzniklý borát silně nukleofilní.[16] Pokud se v molekule nukleofilu nachází nenasycená funkční skupina nebo odstupující skupina v poloze α, tak jedna se z R skupin navázaných na bor může přesunout na elektrofilní α uhlík. Náchylnost organické skupiny k přesunu závisí na její schopnosti stabilizovat záporný náboj a obecně klesá v řadě alkynyl > aryl ≈ alkenyl > primární alkyl > sekundární alkyl > terciární alkyl.[25] Při přesunu dochází k zachování konfigurace migrujících atomů uhlíku[26] a převrácení konfigurace na migračním konci (protože je sp3 hybridizován).[27] Z tohoto důvodu se často jako hydroborační činidla často používají (norbornyl)boran a 9-BBN, jelikož pouze R skupiny odvozené od hydroborovaných alkenů jsou náchylné k přesunu po nukleofilní aktivaci.

Jako nukleofily zde jsou často používány α-haloenoláty. Po nukleofilním ataku na boru se vzniklý ketoboronát přesmykne na neutrální enolboran. Následně proběhne protonolýza a vznikne funkcionalizovaná karbonylová sloučenina.[28]

Alkynylboronáty jsou víceúčelovými meziprodukty, jež mohou být přeměněny na ketony nebo alkeny po současném proběhnutí přesunu a ataku alkynu na odděleném elektrofilu. Elektrofil a přesunující se skupina jsou ve výsledném produktu ve vzájemné poloze trans. Protonolýzou tohoto meziproduktu se vytvoří alken,[29] zatímco oxidací vznikne po tautomerizaci keton.[30]

Možnosti a omezení
Organoborany a boráty mají jako reaktanty v organické syntéze široké využití. Reakce organoboritých sloučenin lze použít k přípravě alkoholů, karbonylových sloučenin, organohalogenidů, peroxidů, aminů i jiných funkčních skupin, v závislosti na použitých výchozích materiálech a podmínkách reakce.
Příprava alkoholů z organoboranů a borátů je ovlivňována druhem nukleofilní skupiny přesunující se na karbonyl či oxidací organoboranového meziproduktu. Homologované primární alkoholy mohou být připraveny reakcemi organoboranů s oxidem uhelnatým a hydridem.[31]

Terciární alkoholy s dvěma stejnými skupinami na alkoholovém uhlíku je možné získat dvojitým přesmykem alkynylborátů za přítomnosti kyseliny.[30] Při přidání jednoho ekvivalentu a oxidaci nebo protonolýze dochází k přeměně na ketony nebo alkeny.

Acylaci borátů lze provést pomocí acylhalogenidů. V následujícím případu se získá borát z tri(cyklopentyl)boranu a fenyllithia; tři cyklopentylové skupiny slouží jako „hloupé“ a nedochází u nich k významné migraci.[32]

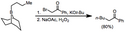
Reakce trialkylboranů s α-haloenoláty vedou ke vzniku funkcionalizovaných ketonů.[28] Jelikož je migrace stereospecifická (konfigurace se vzhledem k přesunující se skupině nemění a vzhledem k α uhlíku se obrací), tak lze tímto způsobem připravit enantiomerně čisté α-alkyl- nebo -arylketony.[33]
Alfa-haloesterové enoláty je také možné adovat na borany; produkty jsou α-funkcionalizované, ovšem výtěžnosti bývají o něco nižší.[34] I diazoestery a diazoketony mohou být takto použity, aniž by bylo potřeba přidávat zásadu.[35] α,α'-Dialo enoláty reagují s borany za vzniku α-halokarbonylových sloučenin, které lze následně funkcionalizovat v pozici α.[36]

Organohalogenidy se z organoboranů dají připravit aktivací hydroxidem či alkoxidem a reakcí s X2. Dvě ze tří alkylových skupin napojených na boran lze přeměnit na halogenid za přítomnosti nadbytku zásady, při použití disiamylboranu jako hydroboračního činidla je ovšem potřeba selektivně halogenovat pouze hydroborovaný alkan.[37]

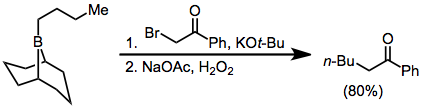
Reakce alkenylboranů s jodem nebo bromem zahrnují přesuny jedné z organických skupin navázaných na bor. Alkynyly po přidání octanu sodného a peroxidu vodíku migrují selektivně za tvorby enynů.[38]

Ostatní využití
Triethylboran (TEB) byl použit k zapálení paliva JP-7 u motorů s proměnným cyklem v letadlech Lockheed SR-71 Blackbird.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Organoboron chemistry na anglické Wikipedii.
- ↑ Negishi, E.-i.; Idacavage, M. J. Org. React. 1985, 33, 1. DOI:10.1002/0471264180.or033.01
- ↑ Advanced Organic Chemistry, F.A. carey, R.J. Sundberg ISBN 0-306-41088-5
- ↑ Brown, H. C. “Organic Syntheses via Boranes” John Wiley & Sons, Inc. New York: 1975. ISBN 0-471-11280-1
- ↑ Ruth A. Bartlett; H. V. Rasika Dias; Marilyn M. Olmstead; Philip P. Power; Kenneth J. Weese. Synthesis of the monomeric HBtrip2 (Trip - 2,4,6-iso-Pr3C6H2) and the x-ray crystal structures of [HBMes2]2 (Mes = 2,4,6,-Me3C6H2) and HBtrip2. Organometallics. 1990, s. 146–150. DOI 10.1021/om00115a023.
- ↑ Segawa Yasutomo, Yamashita Makoto, Nozaki Kyoko. Boryllithium: Isolation, Characterization, and Reactivity as a Boryl Anion. Science. 2006, s. 113–115. DOI 10.1126/science.1131914. PMID 17023656. Bibcode 2006Sci...314..113S.
- ↑ Bethany Halford Boron Attacks Electropositive element pressed into action as nucleophilic boryllithium Chemical & Engineering News 2006; Volume 84(41): 11 Link
- ↑ Boronic Acids: Preparation, Applications in Organic Synthesis and Medicine. Dennis G. Hall ISBN 3-527-30991-8
- ↑ Paetzold Peter, Englert Ulli, Finger Rudolf, Schmitz Thomas, Tapper Alexander, Ziembinski Ralf. Reactions at the Boron-Carbon Double Bond of Methyl(methylidene)boranes. Z. Anorg. Allg. Chem.. 2004, s. 508–518. DOI 10.1002/zaac.200300396.
- ↑ D. P. Curran; A. Solovyev; M. Makhlouf Brahmi; L. Fensterbank; M. Malacria; E. Lacôte. Synthesis and Reactions of N-Heterocyclic Carbene Boranes. Angewandte Chemie International Edition. 2011, s. 10294–10317. DOI 10.1002/anie.201102717. PMID 21898724.
- ↑ Yuzhong Wang, Brandon Quillian, Pingrong Wei, Chaitanya S. Wannere, Yaoming Xie, R. Bruce King, Henry F. Schaefer, Paul v. R. Schleyer, Gregory H. Robinson. A Stable Neutral Diborene Containing a B=B Double Bond. Journal of the American Chemical Society. 2007, s. 12412–12413. Dostupné online. DOI 10.1021/ja075932i. PMID 17887683.
- ↑ Neutral Diborene Is A First Ron Dagani Chemical & Engineering News October 1, 2007 Volume 85, Number 40 p. 10 [1]
- ↑ Holger Braunschweig; Rian D. Dewhurst. Single, Double, Triple Bonds and Chains: The Formation of Electron-Precise B-B Bonds. Angewandte Chemie International Edition. 2013-03-25, s. 3574–3583. ISSN 1521-3773. DOI 10.1002/anie.201208189. PMID 23362015.
- ↑ Merle Arrowsmith; Holger Braunschweig; Tom E. Stennett. Formation and Reactivity of Electron-Precise B−B Single and Multiple Bonds. Angewandte Chemie International Edition. 2017-01-02, s. 96–115. ISSN 1521-3773. DOI 10.1002/anie.201610072. PMID 27860056.
- ↑ Allred, A. L.; Rochow, E. G. J. Inorg. Nucl. Chem. 1958, 5, 264.
- ↑ Negishi, E.-i.; Idacavage, M. J. Organic Reactions 1985, 33, 1. DOI:10.1002/0471264180.or033.01
- ↑ a b Negishi, E.-i. J. Organometal. Chem. 1976, 108, 281.
- ↑ Jacob, III, P.; Brown, H. C. J. Org. Chem. 1977, 42, 579.
- ↑ Rathke, M. W.; Brown, H. C. J. Am. Chem. Soc. 1967, 89, 2740
- ↑ Lachance H., Hall D. Allylboration of Carbonyl Compounds. [s.l.]: [s.n.], 2008. ISBN 978-0471264187. DOI 10.1002/0471264180.or073.01. S. 1.
- ↑ Nicolaou, K.C.; SARABIA, F.; NINKOVIC, S.; FINLAY, M.R.V.; BODDY, C.N.C. Probing the Ring Size of Epothilones: Total Synthesis of 14-, 15-, 17-, and 18 Epothilones A. Angewandte Chemie International Edition in English. 1998, s. 81–84. Dostupné online [cit. 2008-03-02]. DOI 10.1002/(sici)1521-3773(19980202)37:1/2<81::aid-anie81>3.0.co;2-c.
- ↑ Vedejs E., Chapman R. W., Fields S. C., Lin S., Schrimpf M. R. Conversion of Arylboronic Acids into Potassium Aryltrifluoroborates: Convenient Precursors of Arylboron Difluoride Lewis Acids. J. Org. Chem.. 1995, s. 3020–3027. DOI 10.1021/jo00115a016.
- ↑ Molander Gary A., Canturk Belgin. Organotrifluoroborates and Monocoordinated Palladium Complexes as Catalysts—A Perfect Combination for Suzuki–Miyaura Coupling. Angew. Chem. Int. Ed.. 2009, s. 9240–9261. DOI 10.1002/anie.200904306. PMID 19899086.
- ↑ Batey Robert A., Quach Tan D., Shen Ming, Thadani Avinash N., Smil David V., Li Sze-Wan, MacKay D. Bruce. Organoboron compounds as mild nucleophiles in Lewis acid- and transition metal-catalyzed C–C bond-forming reactions. Pure Appl. Chem.. 2002, s. 43–55. Dostupné online. DOI 10.1351/pac200274010043.
- ↑ Norio Miyaura; Akira Suzuki. Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds. Chemical Reviews. 1995, s. 2457–2483. DOI 10.1021/cr00039a007.
- ↑ Miyaura, M.; Sasaki, N.; Itoh, M.; Suzuki, A. Tetrahedron Lett. 1977, 173.
- ↑ Zweifel, G. in Aspects of Mechanism and Organometallic Chemistry, J. H. Bewster, Ed., Plenum, 1978, p. 229
- ↑ Midland, M. M.; Zolopa, A. R.; Halterman, R. L. J. Am. Chem. Soc. 1979, 101, 248.
- ↑ a b Brown, H. C.; Rogi, M. M.; Nambu, H.; Rathke, M. W. J. Am. Chem. Soc. 1969, 91, 2147
- ↑ Corey, E. J.; Ravindranathan, T. J. Am. Chem. Soc. 1972, 94, 4013
- ↑ a b Midland, M. M.; Brown, H. C. J. Org. Chem. 1975, 40, 2845
- ↑ Rathke, M. W.; Brown, H. C. J. Am. Chem. Soc. 1967, 89, 2740
- ↑ Negishi, E.-i.; Abramovitch, A.; Merrill, R. E. Chem. Commun. 1975, 138
- ↑ Nesmeyanov, A. N.; Sokolik, R. A. The Organic Compounds of Boron, Aluminium, Gallium, Indium, and Thallium, North-Holland, Amsterdam, 1967
- ↑ Brown, H. C.; Rogic, M. M.; Rathke, M. W.; Kabalka, G. W. J. Am. Chem. Soc. 1968, 90, 818
- ↑ Hooz, J.; Gunn, D. M. J. Am. Chem. Soc. 1969, 91, 6195.
- ↑ Pasto, D. J.; Wojtkowski, P. W. J. Org. Chem. 1971, 36, 1790
- ↑ Brown, H. C.; Rathke, M. W.; Rogic, M. M. J. Am. Chem. Soc. 1968, 90, 5038
- ↑ Negishi, E.-i.; Lew, G.; Yoshida, T. Chem. Commun. 1973, 874
Související články
- Kovem katalyzovaná hydroborace
Externí odkazy
 Obrázky, zvuky či videa k tématu organoborany na Wikimedia Commons
Obrázky, zvuky či videa k tématu organoborany na Wikimedia Commons
Média použitá na této stránce
Autor: OrganicReactions, Licence: CC BY 3.0
carbon-carbon bond formation from boranes and borates: arylborate acylation with acyl chlorides
Autor: OrganicReactions, Licence: CC BY 3.0
carbon-carbon bond formation from boranes and borates: general scheme
(C6H2(iPr)3)2BH
Autor: OrganicReactions, Licence: CC BY 3.0
transfer of an alkynyl group from an organoborate in the presence of iodine; stereospecific formation of enynes
Autor: OrganicReactions, Licence: CC BY 3.0
carbon-carbon bond formation from boranes and borates: alpha functionalization of alpha-halo enolates
Autor: OrganicReactions, Licence: CC BY 3.0
carbon-carbon bond formation from boranes and borates: formation of halides from bis(sialyl) alkylborates and iodine
(c) V8rik at the English Wikipedia, CC BY-SA 3.0
Alkyltrifluoroborates Batey 2002
Autor: OrganicReactions, Licence: CC BY 3.0
carbon-carbon bond formation from boranes and borates: tertiary alcohol formation from alkynyl borates
Autor: OrganicReactions, Licence: CC BY 3.0
carbon-carbon bond formation from boranes and borates: mechanism of olefin formation from alkynyl borates
Example of allylboration, taken from Nicolaou, K.C.; Sarabia, F.; Ninkovic, S.; Finlay, M.R.V.; Boddy, C.N.C. Angewandte Chemie. International edition in English, 1998, 37, 81-84.
Autor: OrganicReactions, Licence: CC BY 3.0
carbon-carbon bond formation from boranes and borates: mechanism of 1,2-migration
Autor: OrganicReactions, Licence: CC BY 3.0
carbon-carbon bond formation from boranes and borates: formation of alpha-functionalized esters from alpha-halo ester enolates
Autor: Wiremu Stadtwald Demchick, Licence: CC0
Organoboron logo. SVG version of this image.
Autor: OrganicReactions, Licence: CC BY 3.0
carbon-carbon bond formation from boranes and borates: mechanism of enolboronate 1,2-migration to afford alpha-functionalized carbonyl compounds
Autor: OrganicReactions, Licence: CC BY 3.0
Hydroxymethylation of boranes with carbon monoxide