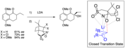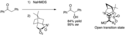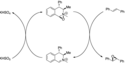Oxaziridin
| Oxaziridin | |
|---|---|
 Strukturní vzorec | |
| Obecné | |
| Systematický název | oxaziridin |
| Anglický název | oxaziridine |
| Sumární vzorec | CH3NO |
| Identifikace | |
| Registrační číslo CAS | 6827-26-5 |
| PubChem | 15817734 |
| SMILES | C1NO1 |
| InChI | 1S/CH3NO/c1-2-3-1/h2H,1H |
| Vlastnosti | |
| Molární hmotnost | 45,04 g/mol |
Některá data mohou pocházet z datové položky. | |
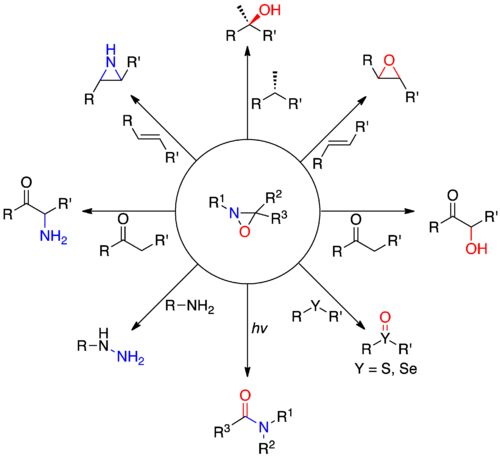
Oxaziridin je organická sloučenina s tříčlenným heterocyklem tvořeným kyslíkovým, dusíkovým a uhlíkovým atomem; název oxaziridiny se také používá pro jeho deriváty, které mají mnohem větší praktický význam než samotná sloučenina, mimo jiné jsou meziprodukty při průmyslové výrobě hydrazinu, dále se používají jako speciální reaktanty v organické chemii při mnoha oxidačních reakcích, jako jsou α hydroxylace enolátů, epoxidace a aziridinace alkenů, a dalších reakcích s přenosem heteroatomu. Oxaziridiny také slouží jako prekurzory amidů a účastní se [3+2] cykloadicí s mnoha heterokumuleny za vzniku substituovaných pětičlenných heterocyklů. Chirální deriváty oxaziridinu způsobují asymetrický přesun kyslíku na prochirální enoláty i jiné substráty. Některé oxaziridiny mají rovněž vysokou bariéru inverze dusíku, což umožňuje vznik chirality na dusíkovém centru.
Historie
Oxaziridinové deriváty popsal v polovině 50. let 20. století William Emmons[1] a následně také H. Krimm[2] a L. Horner s E. Jürgensem.[3]
Na začátku 70. let byl vyvinut peroxidový proces průmyslové výroby hydrazinu skrz oxidaci amoniaku peroxidem vodíku za přítomnosti ketonů.[4] Meziproduktem této syntézy je 3-ethyl-3-methyloxaziridin.
Chirální sulfonyloxaziridiny kafru se ukázaly jako užitečné při výrobě složitějších sloučenin, jako je cytostatikum taxol. Jak Holtonova, tak i Wenderova totální syntéza taxolu zahrnují asymetrickou α-hydroxylaci sulfonyloxaziridinem kafru.
Příprava
N-H, N-alkyl a N-aryloxaziridiny
Dvěma hlavními způsoby přípravy N-H, N-alkyl a N-aryloxaziridinů jsou oxidace iminů peroxokyselinami (A) a aminace karbonylových sloučenin (B).

Oxidací chirálních iminů nebo oxidací jakýchkoliv iminů chirálními peroxokyselinami lze získat enantiomerně čisté oxaziridiny. Byly popsány enantiomerně čisté oxaziridiny s konfiguračně stabilním stomem dusíku.[5]
N-sulfonyloxaziridiny
Na přelomu 70. a 80. let 20. století připravil Franklin Arnold Davis první N-sulfonyloxaziridiny, které působily jako činidla pro přenos kyslíku, a jsou v současné době nejčastěji používanou skupinou oxaziridinů.[6] Původně se syntetizovaly za použití kyseliny m-chlorperoxybenzoové, s benzyltrimethylamoniumchloridem jako katalyzátorem, ovšem byla vyvinuta vylepšená syntéza za použití hydrogenperoxosíranu draselného jako oxidačního činidla, která se nyní používá častěji.[7]
V současnosti se používá řada N-sulfonyloxaziridinů, každý z nich má poněkud odlišné fyzikální vlastnosti a reaktivitu. Níže je zobrazena tabulka různých oxaziridinových činidel.[8][9][10][11][12][13][14][15][16]
Perfluorované oxaziridiny
Perfluoralkylové skupiny silně odtahují elektrony, a oxaziridiny s těmito skupinami se tak více podobají dioxiranům než běžným oxaziridinům.[17] Perfluoroxaziridiny hydroxylují některé vazby C-H s vysokou selektivitou. Mohou být syntetizovány přidáním perfluorovaných iminů k perfluormethylfuorkarbonylperoxidu a fluoridu kovu, kde slouží k zachycování fluorovodíku.[17]

Reakce
Oxaziridiny jsou meziprodukty peroxidového procesu výroby hydrazinu. Tímto procesem, v jehož průběhu je amoniak oxidován ethylmethylketonem za vzniku oxaziridinu, se ročně vyrobí tisíce tun hydrazinu.[18]
- Me(Et)C=O + H3 + H2O2 → Me(Et)CONH + H2O
V dalším kroku je oxaziridin převeden na hydrazon, jenž se okamžitě přeměňuje na hydrazin:
- Me(Et)CONH + NH3 → Me(Et)C=NNH2 + H2O
S přenosem kyslíku
α-hydroxylace enolátů
Acyloinová (α-hydroxyketonová) skupina je přítomná v mnoha přírodních látkách. Enoláty se připravují mnoha způsoby, mezi něž patří redukce α-diketonů, nahrazení hydroxylu jinou skupinou a přímá oxidace na enoláty; nejčastějšími elektrofilními zdroji kyslíku v tomto procesu jsou oxodiperoxymolybden(pyridin)-(triamid kyseliny hexamethylfosforečné) (MoOPH) a N-sulfonyloxaziridiny. Jednou z výhod použití N-sulfonyloxaziridinů je vyšší chirální indukce, než u MoOPH a dalších oxidačních činidel.[19] U α-hydroxylace Evansovými chirálními pomocníky s N-sulfonyloxaziridiny jako elektrofily byla zjištěna vysoká výtěžnost (77–91 %).[19] Chirální indukce byla zjištěna u mnoha dalších chirálních ketonů a ketonů s chirálními pomocníky, jako jsou SAMP a RAMP.[8]

Byla popsána řada asymetrických hydroxylací prochirálních enolátů pomocí derivátů sulfonyloxaziridinu kafru, za dosažení středního až vysokého enantiomerního přebytku.[11]

Selektivita některých hydroxylací může být v některých případech výrazně ovlivněna připojením koordinačních skupin na alfa pozici oxaziridinu, jako je tomu u oxaziridinů 3b a 3c ve výše uvedené tabulce.[14] Předpokládá se, že v těchto případech probíhá reakce přes uzavřený přechodný stav, kde je kovový oxyanion stabilizován chelatací síranovými a koordinačními skupinami v molekule kafru.[8]

α-Hydroxylace za použití oxaziridinů se často využívá v totálních syntézách. Je klíčovým krokem při Holtonově i Wenderově totální syntéze taxolu. Craig J. Forsyth ji využil při své syntéze C3-C14 substitutovaného 1,7-dioxaspiro[5.5]undec-3-enového systému kyseliny okadaiové.[20]

Epoxidace alkenů
Epoxidace alkenů je běžná reakce, jelikož deriváty epoxidů lze připravit mnoha různými způsoby; příkladem je laboratorní epoxidace za použití mCPBA nebo jiné peroxokyseliny. Oxaziridiny jsou ožitečné při tvorbě epoxidů velmi citlivých na kyseliny.[5] (−)-Chaetominin byl syntetizován přes oxaziridinovou epoxidaci, tak, jak je zobrazeno na následujícím obrázku.[21]

Další podobná přeměna s vysokou syntetickou užitečností je asymetrická epoxidace. Exustuje velké množství těchto epoxidací: Sharplessova epoxidace, Jacobsenova-Katsukiova epoxidace a Juliá-Colonnova epoxidace. Tyto reakce vyžadují specifickou funkcionalitu, aby bylo dosaženo selektivity. Sharplessova epoxidace probíhá u allylových alkoholů, Jacobsenova epoxidace vyžaduje cis-disubstitutované arylalkeny a k Juliá-Colonnova epoxidaci dochází u α-β nenasycených ketonů. Chirální oxaziridiny fungují u mnoha nefunkcionalizovaných alkenů stereospecificky.[5] Je dokonce možné katalyticky provést stereospecifickou epoxidaci na oxaziridinové chirální jednotce. Je potřeba další výzkum v této oblasti, neboť hodnoty enantiomerního přčebytku jsou důležité při syntézách v průmyslovém měřítku. Lusinichi et al. studovali asymetrickou epoxidaci chirální oxaziridiniové soli za použití hydrogenperoxosíranu draselného jako oxidačního činidla.[22]

Hydroxylace neaktivovaných uhlovodíků
O perfluorovaných oxaziridinech je známo, že mohou hydroxylovat neaktivované uhlovodíky s výraznou regio- a diastereospecificitou.[17] Tato přeměna je značně žádaná; obdobná reaktivita a specificita se vyskytuje jen zřídka, obzvláště u nekovových oxidačních činidel. Perfluorované oxaziridiny vykazují také vysokou selektivitu vůči terciárním atomům vodíku. Hydroxylace primárních uhlíků a dihydroxylace sloučenin s dvěma oxidovatelnými místy nebyly nikdy pozorovány. Zachování stereochemie je velmi výrazné, často 95 - 98% (lze jej dále navýšit přidáním fluoridové soli).[23]

S přenosem dusíku
U oxaziridinů s nesubstituovanými či acylovanými dusíky může proběhnout přesun dusíkového atomu; těmto reakcím není věnováno tolik pozornosti jako reakcím s přenosem kyslíku.
Aminace N-nukleofilů
Aminace nukleofilů N-nesubstituovanými oxaziridiny je všestrannou reakcí díky velkému počtu možných nukleofilů a tedy i výsledných produktů. Hydraziny lze získat aminací sekundárních nebo terciárních aminů, hydroxylaminy a thiohydroxylaminy lze připravit z odpovídajících alkoholů a thiolů, sulfimid se dají připravit z thioetherů a α-aminoketony z odpovídajících enolátů.[24]

N-acylamidace
Přesun acylovaných aminů je většinou obtížnější než přesun nesubstituovaných aminů, to ovšem neplatí při přesunu aminů u oxaziridinů. kde je přímý přesun acylovaných amidů jedinou možností.[24] Přesun acylaminů se obvykle provádí za použití aminů a hydrazinů jako nukleofilů. Úspěšně bylo provedeno jen několik málo přesunů acylovaných dusíků na uhlíkové nukleofily, i když byly některé takové reakce popsány v odborné literatuře.[24]

Přesmyky
Bylo zjištěno, že u oxaziridinů probíhají při ozáření ultrafialovým zářením nebo za přítomnosti látky schopné přesunu jednoho elektronu (jako je Cu+) radikálové přesmykové reakce. Spirocyklické oxaziridiny podléhají rozšíření cyklu na odpovídající laktam.[25] To, která skupina bude přesunuta, je určováno stereoelektronovým efektem, kde jsou skupiny v poloze trans vůči volnému elektronovému páru dusíku vždy hlavním produktem přesunu; je tak možné řídit reakci zvýhodněním chirálního dusíku. Tento jev je ukázán na pozorovaných selektivitách níže uvedených přesmyků. U přesmyku nalevo byl pozorován pouze termodynamicky nevýhodný produkt, zatímco u reakce vpravo je upřednostněn produkt odvozený od méně stabilního radikálového meziproduktu.[25]
Tato reakce je důležitou součástí Aubého syntézy (+)-yohimbinu,[25] přírodního léčiva, o němž se předpokládá, že může léčit erektilní dysfunkci a sexuální problémy způsobené selektivními inhibitory zpětného vychytávání serotoninu.[26]

Významnou vlastností oxaziridinů je rovněž skutečnost, že se tepelně přesmykují na nitrony. Cis-trans selektivita této reakce je nízká, ovšem výnosnost vysoká až velmi vysoká. Předpokládá se, že se některé oxaziridiny časem racemizují přes nitronové meziprodukty.[5]

Cykloadice s heterokumuleny
Oxaziridiny mohou podstoupit cykloadiční reakce s heterokumuleny za vzniku různých pětičlenných heterocyklů, tak jak je to zobrazeno níže na obrázku. Tato reaktivita je způsobena pnutím tříčlenného cyklu a také tím, že vazba N-O je slabá.[5]

Reference
V tomto článku byl použit překlad textu z článku Oxaziridine na anglické Wikipedii.
- ↑ Emmons, W. D. J. Am. Chem. Soc.. 1956, s. 6208. DOI 10.1021/ja01604a072. (anglicky)
- ↑ Krimm, H. Chem. Abstr.. 1957. (anglicky)
- ↑ Horner, L.; JÜRGENS, E. Notiz Über Darstellung und Eigenschaften Einiger Isonitrone (Oxazirane). Chemische Berichte. 1957, s. 2184. DOI 10.1002/cber.19570901010. (anglicky)
- ↑ Method for preparing azines and hydrazones. Původci vynálezu: Jean-Pierre SCHIRMANN, Jean COMBROUX, Serge Yvon DELAVARENNE. Spojené státy americké. Patentový spis 3972878. 1976-08-03. ; Process for the preparation of hydrazine compounds. Původci vynálezu: Jean-Pierre SCHIRMANN, Pierre TELLIER, Henri MATHAIS. Spojené státy americké. Patentový spis 3978049. 1976-08-31.
- ↑ a b c d e Davis, F. A.; SHEPPARD, A. C. Applications of oxaziridines in organic synthesis. Tetrahedron. 1989, s. 5703. DOI 10.1016/s0040-4020(01)89102-x. (anglicky)
- ↑ Davis, F. A.; STRINGER, O. D. Chemistry of oxaziridines. 2. Improved synthesis of 2-sulfonyloxaziridines. The Journal of Organic Chemistry. 1982, s. 1774. DOI 10.1021/jo00348a039. (anglicky)
- ↑ Davis, F. A.; CHATTOPADHYAY, S.; TOWSON, J. C.; LAL, S.; REDDY, T. Chemistry of oxaziridines. 9. Synthesis of 2-sulfonyl- and 2-sulfamyloxaziridines using potassium peroxymonosulfate (oxone). The Journal of Organic Chemistry. 1988, s. 2087. DOI 10.1021/jo00244a043. (anglicky)
- ↑ a b c Davis, F. A.; CHEN, B. C. Asymmetric hydroxylation of enolates with N-sulfonyloxaziridines. Chem. Rev.. 1992, s. 919. DOI 10.1021/cr00013a008. (anglicky)
- ↑ Davis, F. A.; JENKINS, R. H.; AWAD, S. B.; STRINGER, O. D.; WATSON, W. H.; GALLOY, J. Chemistry of oxaziridines. 3. Asymmetric oxidation of organosulfur compounds using chiral 2-sulfonyloxaziridines. Journal of the American Chemical Society. 1982, s. 5412. DOI 10.1021/ja00384a028. (anglicky)
- ↑ Davis, F. A.; REDDY, R. T.; MCCAULEY, J. P.; PRZESLAWSKI, R. M.; HARAKAL, M. E.; CARROLL, P. J. Chemistry of oxaziridines. 15. Asymmetric oxidations using 3-substituted 1,2-benzisothiazole 1,1-dioxide oxides. The Journal of Organic Chemistry. 1991, s. 809. DOI 10.1021/jo00002a056. (anglicky)
- ↑ a b Towson, J. C.; WEISMILLER, M. C.; LAL, S. G.; SHEPPARD, A. C.; DAVIS, F. A. Org. Synth.. 1990, s. 158. (anglicky)
- ↑ Davis, F. A.; TOWSON, J. C.; WEISMILLER, M. C.; LAL, S.; CARROLL, P. J. Chemistry of oxaziridines. 11. (Camphorylsulfonyl)oxaziridine: synthesis and properties. Journal of the American Chemical Society. 1988, s. 8477. DOI 10.1021/ja00233a025. (anglicky)
- ↑ Bach, R. D.; CODDENS, B. A.; MCDOUALL, J. J. W.; SCHLEGEL, H. B.; DAVIS, F. A. The mechanism of oxygen transfer from an oxaziridine to a sulfide and a sulfoxide: a theoretical study. The Journal of Organic Chemistry. 1990, s. 3325. DOI 10.1021/jo00297a062. (anglicky)
- ↑ a b Davis, F. A.; KUMAR, A.; CHEN, B. C. Chemistry of oxaziridines. 16. A short, highly enantioselective synthesis of the AB-ring segments of .gamma.-rhodomycionone and .alpha.-citromycinone using (+)-[(8,8-dimethoxycamphoryl)sulfonyl]oxaziridine. The Journal of Organic Chemistry. 1991, s. 1143. DOI 10.1021/jo00003a042. (anglicky)
- ↑ Davis, F. A.; WEISMILLER, M. C.; LAL, G. S.; CHEN, B. C.; PRZESLAWSKI, R. M. (Camphorylsulfonyl)imine dianion in the synthesis of new optically pure (camphorylsulfonyl)oxaziridine derivatives. Tetrahedron Letters. 1989, s. 1613. DOI 10.1016/s0040-4039(00)99534-0. (anglicky)
- ↑ Chen, B. C.; WEISMILLER, M. C.; DAVIS, F. A.; BOSCHELLI, D.; EMPFIELD, J. R.; SMITH, A. B. Enantioselective synthesis of (+)-kjellmanianone. Tetrahedron. 1991, s. 173–82. DOI 10.1016/S0040-4020(01)80914-5. (anglicky)
- ↑ a b c Petrov, V. A.; Resnati, G.. Polyfluorinated Oxaziridines: Synthesis and Reactivity. Chemical Reviews. 1996, s. 1809. DOI 10.1021/cr941146h. (anglicky)
- ↑ Jean-Pierre Schirmann, Paul Bourdauducq "Hydrazine" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002. DOI:10.1002/14356007.a13_177.
- ↑ a b Evans, D. A.; MORRISSEY, M. M.; DOROW, R. L. Asymmetric oxygenation of chiral imide enolates. A general approach to the synthesis of enantiomerically pure .alpha.-hydroxy carboxylic acid synthons. Journal of the American Chemical Society. 1985, s. 4346. DOI 10.1021/ja00300a054. (anglicky)
- ↑ Dounay, Amy B.; FORSYTH, CRAIG J. Abbreviated Synthesis of the C3−C14 (Substituted 1,7-Dioxaspiro[5.5]undec-3-ene) System of Okadaic Acid. Org. Lett.. 1999, s. 451. DOI 10.1021/ol9906615. (anglicky)
- ↑ Malgesini, Beatrice; FORTE, BARBARA; BORGHI, DANIELA; QUARTIERI, FRANCESCA; GENNARI, CESARE; PAPEO, GIANLUCA. A Straightforward Total Synthesis of (−)-Chaetominine. Chem. Eur. J.. 2009, s. 7922. DOI 10.1002/chem.200900793. (anglicky)
- ↑ Bohé, Luis; HANQUET, GILLES; LUSINCHI, MARIE; LUSINCHI, XAVIER. The stereospecific synthesis of a new chiral oxaziridinium salt. Tetrahedron Letters. 1993, s. 7271. DOI 10.1016/S0040-4039(00)79306-3. (anglicky)
- ↑ Arnone, Alberto; FOLETTO, STEFANIA; METRANGOLO, PIERANGELO; PREGNOLATO, MASSIMO; RESNATI, GIUSEPPE. Highly Enantiospecific Oxyfunctionalization of Nonactivated Hydrocarbon Sites by Perfluoro-cis-2-n-butyl-3-n-propyloxaziridine. Org. Lett.. 1999, s. 281. DOI 10.1021/ol990594e. (anglicky)
- ↑ a b c Andreae, S.; SCHMITZ, E. ChemInform Abstract: Electrophilic Aminations with Oxaziridines. ChemInform. 1991, s. 327. DOI 10.1002/chin.199146339. (anglicky)
- ↑ a b c Aubé, Jeffrey. Oxiziridine rearrangements in asymmetric synthesis. Chemical Society Reviews. 1997, s. 269. DOI 10.1039/CS9972600269. (anglicky)
- ↑ Yohimbe: MedlinePlus Supplements [online]. nlm.nih.gov, November 19, 2010 [cit. 2010-12-13]. Dostupné online. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Oxaziridin na Wikimedia Commons
Obrázky, zvuky či videa k tématu Oxaziridin na Wikimedia Commons
Média použitá na této stránce
Chemical structure of oxaziridine
(c) DMelvinKaphan na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Wybrane reakcje świadczące o wysokiej reaktywności oksazyrydyny
Autor: DMelvinKaphan, Licence: CC BY-SA 3.0
Heterocumulene cyclization with an oxizolidinone
Autor: DMelvinKaphan, Licence: CC BY-SA 3.0
Hydroxylation of unactivated hydrogcarbons
Autor: DMelvinKaphan, Licence: CC BY-SA 3.0
total synthesis using alpha hydroxylation