Oxid fosforečný
| Oxid fosforečný | |
|---|---|
 Strukturní vzorec oxidu fosforečného | |
 3D model oxidu fosforečného | |
| Obecné | |
| Systematický název | Oxid fosforečný |
| Anglický název | Phosphorus pentoxide |
| Německý název | Phosphorpentoxid |
| Sumární vzorec | P2O5 (monomer) P4O10 (dimer) |
| Vzhled | Bezbarvá hygroskopická pevná látka |
| Identifikace | |
| Registrační číslo CAS | 1314-56-3 16752-60-6 (dimer P4O10) |
| PubChem | 14812 |
| SMILES | O=P13OP2(=O)OP(=O)(O1)OP(=O)(O2)O3 |
| InChI | InChI=1S/O10P4/c1-11-5-12(2)8-13 (3,6-11)10-14(4,7-11)9-12 |
| Číslo RTECS | TH3945000 |
| Vlastnosti | |
| Molární hmotnost | 283,889 g/mol |
| Teplota tání | 422 °C (mod. M, zvýšený tlak) 558 °C (mod. R) 583 °C (mod. S) |
| Teplota sublimace | 359 °C (mod. M) 300 °C (amorfní mod.) |
| Hustota | 2,28 g/cm3 (mod. M) 2,72 g/cm3 (mod. R) 2,89 g/cm3 (mod. S) 2,38–2,39 g/cm3 (amorfní mod.) |
| Index lomu | modifikace M nDř= 1,469 nDm= 1,471 modifikace R nDa= 1,545 nDb= 1,578 nDc= 1,589 modifikace S nDa= 1,589 nDb= 1,599 nDc= 1,624 |
| Rozpustnost ve vodě | Prudká hydrolýza (vznik kyseliny fosforečné, všechny mod.) |
| Rozpustnost v polárních rozpouštědlech | Rozpustné v kyselině sírové (všechny mod.) |
| Měrná magnetická susceptibilita | −2,26×10−6 cm3g−1 |
| Struktura | |
| Krystalová struktura | klencová (mod. M) kosočtverečná plošně centrovaná (mod. R) Kosočtverečná (mod. S) |
| Hrana krystalové mřížky | modifikace M a= 744 pm α= 87° modifikace R a= 1 630 pm b= 814 pm c= 526 pm modifikace S a= 923 pm b= 718 pm c= 494 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −2 985 kJ/mol (mod. M) −2 978 kJ/mol (mod. S) −3 043 kJ/mol (amorfní mod.) |
| Entalpie tání ΔHt | 252 J/g (mod. R) 260 J/g (mod. S) |
| Entalpie sublimace ΔHsub | 130 J/g (mod. M) |
| Standardní molární entropie S° | 229 JK−1mol−1 (mod. M) |
| Standardní slučovací Gibbsova energie ΔGf° | −2 699 kJ/mol (mod. M) |
| Izobarické měrné teplo cp | 0,746 JK−1g−1 (mod. M) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R35 |
| S-věty | S1/2, S22, S26, S45 |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Oxid fosforečný (P4O10) je anorganický oxid. Je to nejběžnější a nejdůležitější oxid fosforu. Vzniká hořením fosforu na vzduchu a vzhledem připomíná bílý prášek. Je dobře rozpustný v mnoha organických rozpouštědlech a je silně hygroskopický.
Struktura
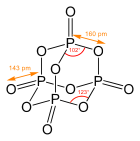
Molekula má adamantanoidní tvar, je tvořena čtyřmi šestičlennými cykly P3O3 s židličkovou konformací. Symetrie molekuly je tetraedrická.
Oxid fosforečný tvoří nejméně čtyři polymorfní krystalové modifikace.
Příprava
Oxid fosforečný se připravuje řízenou oxidací bílého fosforu na vzduchu, při tlaku 12 kPa. Vznikající produkt je kontinuálně oddestilováván z reakční směsi.
- P4 + 5 O2 → P4O10
Použití
Někdy se používá jako dehydratační činidlo, ale jeho využitelnost je snížena tvorbou viskózního fosforečnanového gelu na povrchu oxidu, který brání další hydrolýze.
- P4O10 + 6 H2O → 4 H3PO4 (-177 kJ)
Při reakci s karboxylovou kyselinou vzniká odpovídající anhydrid:
- P4O10 + RCO2H → P4O9(OH)2 + [RC(O)]2O
Příbuzné oxidy fosforu
Mezi P4O6 a P4O10 existují tři oxidy, které se liší počtem exocyklicky vázaných kyslíků.
Reference
- ↑ a b Phosphorus pentoxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu Oxid fosforečný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Oxid fosforečný na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Autor: raster original by Benjah-bmm27
Vektorizace: B. Jankuloski, Licence: CC0
Phosphorus pentoxide chemical structure in 2D.







