Oxid jodičný
| Oxid jodičný | |
|---|---|
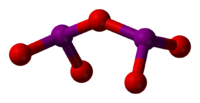 Tyčinkový model molekuly | |
 Kalotový model molekuly | |
| Obecné | |
| Systematický název | Oxid jodičný |
| Ostatní názvy | anhydrid kyseliny jodičné |
| Anglický název | Iodine pentoxide Iodine(V) oxide Iodic anhydride |
| Německý název | Diiodpentoxid |
| Sumární vzorec | I2O5 |
| Vzhled | bílá hygroskopická krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 12029-98-0 |
| PubChem | 159402 |
| SMILES | O=I(=O)OI(=O)=O |
| InChI | 1S/I2O5/c3-1(4)7-2(5)6 |
| Vlastnosti | |
| Molární hmotnost | 333,81 g/mol |
| Teplota rozkladu | 300 °C (573 K) |
| Hustota | 4,980 g/cm3 |
| Rozpustnost ve vodě | rozpustný |
| Rozpustnost v polárních rozpouštědlech | rozpustný v kyselině dusičné, nerozpustný v ethanolu |
| Rozpustnost v nepolárních rozpouštědlech | nerozpustný v diethyletheru a CS2 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Oxid jodičný je anorganická sloučenina se vzorcem I2O5. Je to anhydrid kyseliny jodičné a jediný stabilní oxid jodu. Vyrábí se dehydratací kyseliny jodičné při teplotě 200 °C v proudu suchého vzduchu:
- 2 HIO3 → I2O5 + H2O
Struktura
I2O5 má vazebný úhel I-O-I o velikosti 139,2°, ale molekula není zrcadlově symetrická. Koncové vazby I-O mají délku kolem 180 pm a vazby vycházející z prostředního atomu kyslíku jsou přibližně 195 pm dlouhé.
Reakce
Oxid jodičný snadno již za pokojové teploty oxiduje oxid uhelnatý na oxid uhličitý:
- 5 CO + I2O5 → I2 + 5 CO2
Tuto reakci lze použít ke stanovení obsahu CO v plynném vzorku.
I2O5 tvoří s oxidem sírovým a S2O6F2 jodylové soli, ovšem s koncentrovanou kyselinou sírovou tvoří jodosylové soli.
Při zahřátí nad 300 °C se oxid jodičný rozkládá za vzniku plynného jodu a kyslíku.[2]
Reference
V tomto článku byl použit překlad textu z článku Iodine pentoxide na anglické Wikipedii.
- ↑ a b Iodine pentoxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ G. Baxter and G. Tilley, "A Revision of the Atomic Weights of Iodine and Silver," The Chemical News and Journal of Industrial Science; Volumes 99-100, Royal Society Anniversary Meeting, December 3, 1909, p. 276. (Google Books)
Externí odkazy
 Obrázky, zvuky či videa k tématu Oxid jodičný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Oxid jodičný na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Space-filling model of the iodine pentoxide molecule, I2O5.
Ball-and-stick model of the iodine pentoxide molecule, I2O5. Source for structure: Norman N. Greenwood, Alan Earnshaw (1997) Chemistry of the Elements (2nd ed.), Butterworth-Heinemann, p. 851 ISBN: 0-08-037941-9.





