Oxid rutheničitý
| Oxid rutheničitý | |
|---|---|
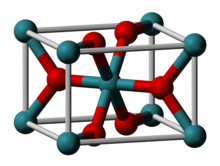 3D model krystalové struktury | |
| Obecné | |
| Systematický název | Oxid rutheničitý |
| Anglický název | Ruthenium dioxide |
| Německý název | Rutheniumdioxid |
| Sumární vzorec | RuO2 |
| Vzhled | modročerná práškovitá látka |
| Identifikace | |
| Registrační číslo CAS | 12036-10-1 |
| 32740-79-7 (hydrát) | |
| Vlastnosti | |
| Molární hmotnost | 133,07 g/mol |
| Teplota rozkladu | 1 100 °C |
| Hustota | 6,97 g/cm3 |
| Rozpustnost ve vodě | nerozpustný |
| Měrná magnetická susceptibilita | 15,7×10−6 cm3g−1 |
| Struktura | |
| Krystalová struktura | čtverečná |
| Hrana krystalové mřížky | a= 449,1 pm c= 310,7 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −305 kJ/mol |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R36 |
| S-věty | S26, S39 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Oxid rutheničitý (RuO2) je sloučeninou kyslíku s rutheniem, které v něm má oxidační číslo IV. Je amfoterní. Je to nejběžnější oxid ruthenia, jde o černomodrou pevnou látku, která krystaluje ve struktuře rutilu.[2] Využívá se jako katalyzátor při elektrolytické výrobě chloru, oxidů chloru a kyslíku.
Příprava
Běžně se připravuje oxidací chloridu ruthenitého. Téměř stechiometrické monokrystaly RuO2 lze připravit chemickým transportem v plynné fázi s kyslíkem jako transportním plynem:
RuO2 + O2 ⇌ RuO4
Tenké filmy oxidu rutheničitého je možno připravit pomocí CVD z těkavých prekurzorů.[3]
Lze jej připravit i přímou oxidací kovového ruthenia kyslíkem za teploty 1000 °C.[2]
Využití
Oxid rutheničitý se využívá jako katalyzátor, např. při výrobě chloru z chlorovodíku[4][5], při Fischerově-Tropschově syntéze[6] nebo v Haberově-Boschově procesu.
RuO2 se využívá jako povrchová úprava titanových anod pro elektrolytickou výrobu chlóru a pro výrobu rezistorů nebo integrovaných obvodů.[7][8] Tyto rezistory lze také využít jako citlivé senzory pro teploty v rozsahu 0.02 - 4 K.[8] Díky velké schopnosti přenosu náboje se využívají v superkondenzátorech. Ve vodném roztoku vykazuje vysokou kapacitu pro ukládání elektrického náboje.[9]
Odkazy
Reference
- ↑ a b Ruthenium(IV) oxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ a b GREENWOOD, NORMAN NEILL. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. Dostupné online. ISBN 8085427389, ISBN 9788085427387. OCLC 320245801 S. 1334.
- ↑ PIZZINI, S.; BUZZANCAE, G. Mat. Res. Bull. 1972, roč. 7, s. 449–462.
- ↑ VOGT, Helmut; BALEJ, Jan; BENNETT, John E. Chlorine Oxides and Chlorine Oxygen Acids. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 9783527306732. DOI 10.1002/14356007.a06_483. S. a06_483. (anglicky) DOI: 10.1002/14356007.a06_483.
- ↑ SEKI, Kohei. Development of RuO2/Rutile-TiO2 Catalyst for Industrial HCl Oxidation Process. Catalysis Surveys from Asia. 2010-9, roč. 14, čís. 3–4, s. 168–175. Dostupné online [cit. 2019-10-30]. ISSN 1571-1013. DOI 10.1007/s10563-010-9091-7. (anglicky)
- ↑ SCHULZ, Hans. Short history and present trends of Fischer–Tropsch synthesis. Applied Catalysis A: General. 1999-10, roč. 186, čís. 1–2, s. 3–12. Dostupné online [cit. 2019-10-30]. DOI 10.1016/S0926-860X(99)00160-X. (anglicky)
- ↑ BIANCHI, G. Fundamental and applied aspects of the electrochemistry of chlorine. Journal of Applied Electrochemistry. 1971-11, roč. 1, čís. 4, s. 231–243. Dostupné online [cit. 2019-10-31]. ISSN 0021-891X. DOI 10.1007/BF00688644. (anglicky)
- ↑ a b SIROUX, Monica; TANG-KWOR, Eric; MATTEÏ, Simone. Measurement Science and Technology. 1998-12, roč. 9, čís. 12, s. 1956–1962. Dostupné online [cit. 2019-10-31]. ISSN 0957-0233. DOI 10.1088/0957-0233/9/12/005.
- ↑ MATTHEY, Johnson. Nanocrystalline Ruthenium Supercapacitor Material. Johnson Matthey Technology Review [online]. [cit. 2019-10-31]. Dostupné online. (anglicky)
Literatura
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu Oxid rutheničitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Oxid rutheničitý na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Autor: CCoil (talk), Licence: CC BY 3.0
Ball-and-stick model of the unit cell of ruthenium(IV) oxide, RuO2.
Structural data from the CrystalMaker 8.1 structure library, originally from Baur W H, Khan A A Acta Crystallographica B27 (1971) 2133-2139.




